Beskerming van metale
In graad 7 en 8 het jy geleer om metale as ysterhoudend en nie-ysterhoudend te klassifiseer. In hierdie hoofstuk gaan ons die klassifisering van metale hersien.
Jy gaan leer hoe om metale te beskerm en in stand te hou met behulp van die volgende metodes: verf, galvanisering en elektroplatering. As ons materiale en toerusting in stand hou en herwin, sal dit mynbou verminder. En soos jy teen hierdie tyd weet, is mynbou skadelik vir die omgewing.
Ysterhoudend verwys na die teenwoordigheid van yster (die element op die periodieke tabel) in ’n metaal, byvoorbeeld staal. Ysterhoudende metale het oor die algemeen ’n geneigdheid om met suurstof te verbind en hierdie proses word "oksidasie" genoem.
Nie-ysterhoudende metale soos aluminium, koper, sink en goud, bevat geen ystermolekules nie. Hierdie metale is oor die algemeen duurder as ysterhoudende metale.

Om metale te verf

Alhoewel metale (soos wat ons hulle oor die algemeen waarneem) baie sterk is, vergaan hulle ook oor tyd. Roes is een van die mees algemene maniere waarop metale vergaan. Plante en diere gaan dood, verander in kompos en keer terug na die grond. Wanneer metale roes, breek hulle in kleiner deeltjies af en keer ook terug in die grond in. Soos jy teen hierdie tyd weet, word metale oorspronklik uit die grond gehaal deur mynbou.
Maar wat veroorsaak roes? Wanneer ’n metaal met suurstof reageer, vind daar ’n chemiese reaksie plaas wat ons oksidasie noem. Die gevolg van oksidasie is roes. Ysterhoudende metale het nie weerstand teen roes nie. Hierdie reaksie vind baie vinniger plaas wanneer daar sout of sekere sure in die lug is. Metale by die see roes oor die algemeen baie vinniger as metale in die binneland (sien figuur 3).
Daar is egter goeie nuus. Daar is verskeie maniere om metale teen roes te beskerm. Die goedkoopste manier om ysterhoudende metale teen roes te beskerm, is om die metaal te verf.

Wat is die regte manier om metaal te verf? Dit hang af of die metaal splinternuut is en of dit reeds geroes is.


Indien dit ’n splinternuwe stuk metaal is wat nog nooit geverf is nie, sal die metaal se oppervlak glad wees. Dit is dan beter om die metaal oppervlak eers effens grof te maak. Verf sukkel om aan gladde oppervlaktes te kleef en daarom gebruik ons ’n staalborsel (figuur 4) of skuurpapier (figuur 5) om die oppervlak growwer te maak. Daarna moet jy seker maak dat daar geen stof op die oppervlakte agterbly nie. Gebruik ’n skoon lap om die stof van die metaal af te vee. Dan verf jy een laag (of verkieslik twee lae) onderlaag op. Die onderlaag beskerm die metaal en dit moontlik vir die mooi bo-laag verf om aan die metaal se oppervlak te kleef. Laastens, sodra die onderlaag droog is, kan jy uiteindelik die bo- laag verf.
Om geroesde stukke metaal te verf, is bietjie meer werk. Eerstens moet mens van soveel roes as moontlik probeer ontslae raak. Indien daar ou verf is wat afskilfer, moet mens dit ook verwyder. Mens gebruik ’n staalborsel en skuurpapier om dit te doen. Dit is moeilik om van alle roes ontslae te raak, daarom moet mens n spesiale onderlaag opsit wat die oksidasieproses keer. Indien jy nie so ’n onderlaag opsit nie, kleef die metaal net eenvoudig aan die roes onder die verf vas en die verf skilfer sommer gou af.
Belangrike dinge om in ag te neem wanneer jy verf:
1. Wag tot die laag verf wat jy aanvanklik geverf het heeltemal droog is, voordat jy die volgende laag verf.
2. Maak altyd seker dat die oppervlak wat jy wil verf, heeltemal skoon is. Daar moet geen stof, water of olie daarop wees nie. Stof, water en olie verhoed ook dat verf aan die oppervlak kleef.
Met party soorte roeswerende onderlae moet mens nog ’n ekstra onderlaag bo-op dit ook verf voor mens die bo-laag kan verf. Daarom moet mens altyd die instruksies lees op die spesifieke produk wat jy gebruik. Wanneer mens al die onderlae geverf het, kan jy die bo-laag verf. Nou weet jy hoe om geroesde voorwerpe te herstel en mooi te maak, in plaas van om dit weg te gooi!
Beskerm metale deur verfwerk
Beantwoord die volgende vrae:
1. Maak ’n lys van die materiale wat jy gaan nodig hê om metale te verf.
2. Beskryf kortliks waarom dit nodig is om ’n onderlaag aan te wend wanneer jy ’n metaal verf.
3. Verduidelik kortliks in jou eie woorde waarom skepe en bote die deurentyd geverf moet word.
4. Bestudeer die onderstaande tabel. Kolom A beskryf al die stappe in die verfproses, maar die volgorde is deurmekaar. Skryf die korrekte nommer vir elke stap in kolom B.
|
A |
B |
|
1. Double coat with primer. When metals are exposed to oxygen and they lose hydrogen, it results in rust or oxidisation. Primer helps the top coat of paint to stick to the surface. It also makes the metal less vulnerable to the effects of time, especially rust. |
|
|
2. Wend twee onderlae aan. Wanneer ’n metaal aan suurstof blootgestel word en ook waterstof verloor, oksideer (of roes) die metaal. Die onderlaag verf maak dat die bo-laag verf aan die metaal se oppervlak vasklou. Dit help ook om die metaal beter teen roes te beskerm. |
|
|
3. Wend ’n sink-chroom onderlaag aan indien die metaal geroes is. Skuur en skraap eers soveel roes as moontlik af en wend dan hierdie onderlaag aan. Mens hoef nie noodwendig geroesde metaalvoorwerpe weg te gooi nie. |
|
|
4. Verwyder los verf, stof, vetterigheid en ander vuilis van die metaaloppervlak. As mens dit nie doen nie, kan die verf nie aan die staal vaskleef nie. Selfs al lyk die metaal nie vuil nie, moet jy dit nog steeds deeglik afvee. |
|
|
5. Verf. Akriel verf is normaalweg die beste verf om vir metaal te gebruik. Dit is duurder as spuitverf of ander metaalverwe, maar dis ook baie meer duursaam. Werk versigtig en wend die verf egalig aan. |
|
|
6. Lees die etikette. Maak seker jou onder- en bolaag pas bymekaar. Let ook veral op na die tyd wat die verf neem om droog te word. ’n Mens moet altyd seker maak een laag verf is heeltemal droog voor jy nog ’n laag opsit. |
Galvanisering
Benewens om metale te verf, kan mens ook ysterhoudende metaal met ’n dun lagie sink bedek om dit teen roes te beskerm. Hierdie proses staan bekend as galvanisering.
Sink oksideer of roes ook, maar die sink reageer met die suurstof, waterstof en koolstofdioksied in die lug en verander dan na sinkkarbonaat.
Zinc carbonate is quite tough and consequently it protects the metal underneath it. If the zinc carbonate layer gets damaged, more zinc carbonate forms. This can repeat until there is no zinc left on the metal. Then the metal will start to rust.
Sinkkarbonaat is baie gehard en gevolglik beskerm dit die metaal daaronder. Indien die sinkkarbonaatlaag skade opdoen, vorm daar net eenvoudig nog ’n laag sinkkarbonaat. Hierdie proses hou aan tot daar nie meer sink op die metaal oor is nie. Dan eers sal die metaal begin roes.
Die beteken dat galvanisering slegs die roes-proses van ysterhoudende metale uitstel. Dit voorkom nie die roesproses nie. As jy metaal ordentlik en vir ’n lang tyd wil beskerm is dit beter om die metaal te galvaniseer én te verf, soos hulle deesdae met motors doen.
Die woord galvanisering is afgelei van Luigi Galvani se naam. Hy was ’n Italiaanse dokter en wetenskaplike wat in die agtiende eeu eksperimente met elektriese strome gedoen het.
Daar is twee maniere om metaal te galvaniseer. Die een proses noem ons "dompelgalvanisering". Die ander proses staan bekend as "elektrogalvanisering".
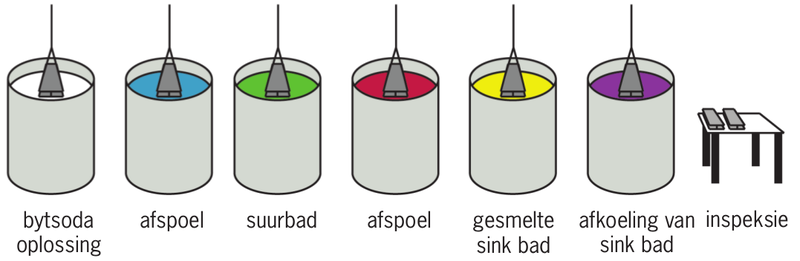
Dompelgalvanisering behels dat die ysterhoudende metaal in ’n bad vol gesmelte sink (met ’n temperatuur van 460°. gedompel word. Water kook teen 100°, jy kan net dink hoe warm die sink is!
Gesmelte – ’n metaal of rots wat in vloeistof vorm is as gevolg van die hitte.
Dit beteken natuurlik dat mens die regte toerusting en veiligheidsmaatreëls in plek moet hê om dompel-galvanisering te doen.
Dompelgalvanisering het twee groot voordele: dis relatief goedkoop en baie duursaam, omdat dit ’n relatief dik sinklaag vorm. Mens kan voorwerpe wat met hierdie metode gegalvaniseer is, buite gebruik, selfs op die langtermyn (soos 20 tot 50 jaar). Maar daar is ook nadele. Eerstens, is die metaal se voorbereidingsproses nogal kompleks (sien figuur 7). Dompelgalvanisering laat metaal ook dof voorkom en die sinklaag is nie orals ewe dik nie.
Elektrogalvanisering behels dat die ysterhoudende metaal deur middel van elektroplatering met ’n sinklaag bedek word. Julle gaan meer leer oor elektroplatering in die volgende deel van hierdie hoofstuk. Nou hoef julle net te weet dat elektrogalvanisering se sinklaag dunner is as die van dompelgalvanisering dis nie so duursaam nie, maar die dikte is egalig. Die sinklaag blink ook; en mens kan selfs klein voorwerpe maklik elektrogalvaniseer. Dit beteken dat metaal wat op hierdie manier gegalvaniseer is, oor die algemeen binnenshuis gebruik word. Indien mens dit buitekant wil gebruik, sal jy die metaal ook moet verf.
Wat het jy geleer?
Galvanisering is ’n proses wat roes help voorkom. Wanneer mens ’n metaal galvaniseer, beteken dit jy bedek die metaal met ’n laag sink. Sink is relatief goedkoop en, anders as yster, reageer dit nie met lug en vog nie. Die sinklaag beskerm die ysterhoudende metaal teen suurstof en water. Voorwerpe wat gegalvaniseer is, is egter nie heeltemal teen roes gevrywaar nie, hulle neem net baie langer om te roes. Die beste manier om ’n metaal te beskerm, is om dit te galvaniseer en te verf.
Beantwoord die vrae hieronder:
1. Bespreek kortliks die doel en funksie van galvanisering.
2. Met watter metaal bedek mens ’n voorwerp as jy dit galvaniseer?
3. Wat is die voordele van dompelgalvanisering?
4. Wat is die nadele van dompelvalganisering?
5. Gee twee voorbeelde van gegalvaniseerde voorwerpe.
Elektroplatering
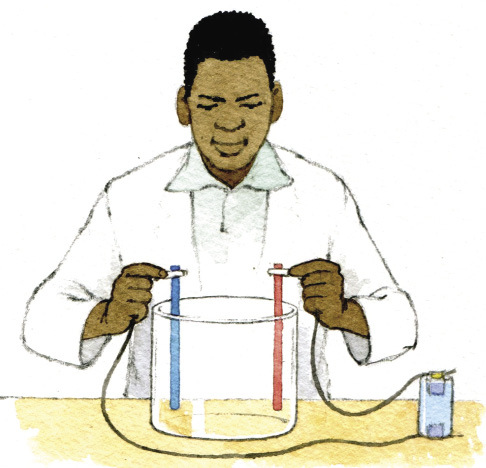
Elektroplatering is ’n proses waardeur een metaal met ’n dun lagie van ’n ander metaal bedek word deur elektrisiteit en ’n soutoplossing (of elektroliet) te gebruik.
Elektroplatering word vir verskeie redes gebruik. Een rede kan wees om die metaal teen roes te beskerm, soos in die geval van galvanisering. ’n Ander rede is om ’n goedkoop metaal baie beter te laat lyk. Koper of silwer juwele word gereeld goudgeplatteer om dit duurder te laat lyk.
’n Elektroliet is ’n mengsel van sout en water wat die vermoeë het om elektrisiteit te gelei.
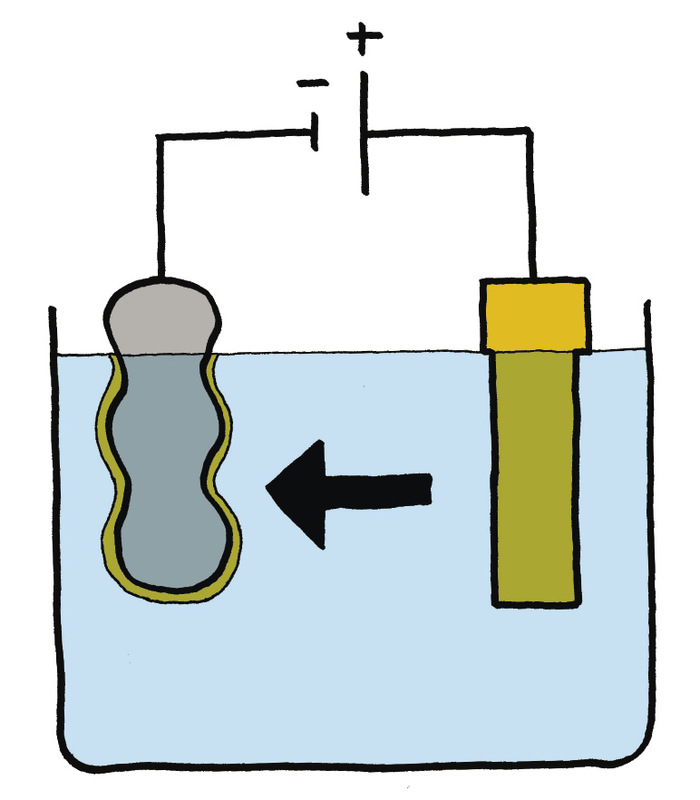
In die praktyk werk elektroplatering so (sien figuur 8 en 9):
die voorwerp wat jy wil elektroplateer word aan die negatiewe kant van ’n sel met ’n draad gekoppel. Die metaal waarmee jy die voorwerp wil plateer, word met ’n draad aan die positiewe kant van die sel gekoppel. Plaas die voorwerp en die metaal (wat aan die drade vas is) in ’n houer gevul met water en ’n soutmengsel.
Die elektrisiteit en metaalmolekules beweeg dan van die positiewe kant na die negatiewe kant toe. Dit beteken dat daar na ’n tydjie ’n dun lagie metaal op die voorwerp begin vorm. Hoe langer mens hierdie proses laat voortduur, hoe dikker sal die metaallaag wees.
Tafelsout is een voorbeeld van ’n sout. Nie alle soute is eetbaar nie, maar alle soute bevat ’n metaal as een van die elemente waaruit hulle saamgestel is. Byvoorbeeld, tafelsout bestaan uit natrium (’n metaal) en chloor. Jy kan nie tafelsout vir elektroplatering gebruik nie.
Kopersulfaat is ook ’n sout. Dit bestaan uit koper (’n metaal) en swael. Kopersulfaat is egter BAIE GIFTIG. Mens kan dit vir elektroplatering gebruik, maar definitief nie om te eet nie!

Werk in ’n groep en ondersoek korrosie
In hierdie eksperiment gaan julle die effek van sout en water op gegalvaniseerde en ongegalvaniseerde metale ondersoek. Wanneer julle alles bymekaar het, gaan dit baie vinnig wees om die eksperiment voor te berei. Maar dan gaan julle die eksperiment op ’n veilige plek moet bêre waar julle die reaksie vir ’n week of selfs langer kan waarneem.
Jy het die volgende nodig vir hierdie aktiwiteit:
- ’n plastiek of glashouer (dit moet nie ’n metaal houer wees nie);
- genoeg water om hierdie houer vol te maak;
- ’n pakkie tafelsout;
- twee gegalvaniseerde metaalvoorwerpe, soos ’n gegalvaniseerde spyker, ’n blikkie (soos waarin ’n mens ingemaakte vis in koop) of ’n stuk sinkplaat (wenk: kyk na die laaste antwoord op p11)
- iets grof of skerp waarmee jy die galvanisering van een van die voorwerpe kan afkrap (soos ’n spyker of skuurpapier of ’n ander stuk metaal).
Blikkies soos die waarin ons kos koop is staal wat vertin is deur elektroplatering op staal.
Hoe om die eksperiment te doen:
- Verhit die water en los die pakkie sout daarin op.
- Gooi die water-en-sout-mengsel in die glas of plastiekhouer wanneer dit afgekoel het.
- Plaas een van jou gegalvaniseerde metaal items net so in die water in die water.
- Gebruik die growwe/skerp voorwerp om ’n stuk van die oppervlak van die ander voorwerp af te krap.
- Plaas die tweede voorwerp ook in die water-en-sout-mengsel.
- Laat albei voorwerpe vir ten minste ’n week in die water en die ander in die soutmengsel staan.
- Haal albei voorwerpe elke dag uit om te sien wat gebeur.
Beantwoord die vrae hieronder:
1. Watter voorwerp begin eerste roes?
2. Hoe lank neem dit vir die metaal om te begin roes?
3. Is daar ’n verskil tussen die roes aan die begin van die week en die roes aan die einde van die week?
4. Waarom roes die ander voorwerp nie?
Wat het jy geleer?
Julle het van drie metodes geleer hoe mens ysterhoudende metale teen roes kan beskerm: verf, galvanisering en elektroplatering. Deur metale te beskerm en te behandel, kan die metale langer hou, wat beteken dat ’n mens minder hoef te myn. ’n Mens kan ook geroesde metaalvoorwerpe hergebruik as jy die roes skoonmaak en dit verf.
Deur metale te hergebruik en te herwin, kan ons ’n positiewe impak op die omgewing maak.
Volgende week
In die volgende hoofstuk gaan julle leer hoe om voedsel langer te laat hou deur dit te verwerk.



