H2
Reaksies van sure met metale
Hoofstukoorsig
0.5 week
Hierdie is 'n kort hoofstuk om die reeks reaksies af te sluit waaraan leerders in hierdie kwartaal blootgestel is. Die laaste reaksies waarna gekyk sal word is dié tussen 'n suur en 'n metaal. Aan die einde van die hoofstuk is daar 'n kort aktiwiteit wat betrekking het op sommige van die loopbane in die chemiese nywerheid. Alhoewel dit nie is vir assesseringsdoeleindes is nie, en as daar nie tyd is om dit in die klas te doen nie, moedig ons jou aan om die leerders te kry of aan te moedig om dit as 'n huiswerkaktiwiteit uit te voer. Om die toepassing van wat in die klaskamer geleer word in die groter wêreld te sien, is 'n baie belangrike deel van die leerproses sowel as om te ontdek wat moontlik gemaak word deur wetenskap en tegnologie.
7.1 Die reaksie van 'n suur met 'n metaal (1.5 uur)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Toetsing vir waterstofgas | Herroeping, balansering van chemiese vergelykings | Opsioneel |
Ondersoek: Die reaksie tussen magnesium en soutsuur | Hipotesevorming, bereiding, meting, waarneming, interpretering | KABV aanbeveling |
Aktiwiteit: Die skryf van die chemiese vergelyking | Skryf en balansering van chemiese vergelykings | Opsioneel (Voorgestel) |
Aktiwiteit: Ander loopbane in chemie | Navorsing, vergelyking, beskrywing | Opsioneel |
- Wat kry ons wanneer 'n metaal met 'n suur reageer?
- Wat is die algemene vergelyking vir die reaksie tussen 'n metaal en 'n suur?
- Hoe skryf ons die woordvergelyking en die gebalanseerde chemiese vergelyking?
- Hoe kan ons vir die teenwoordigheid van waterstof toets?
Die reaksie van 'n suur met 'n metaal
- diatomies
- digtheid
- karakteristieke
- teenwoordigheid
- chemikus
- apteker
In die vorige hoofstuk het ons geleer van die reaksies van sure met 'n verskeidenheid basisse: metaaloksiede, metaalhidroksiede en mataalkarbonate. Ons het geleer hoe om algemene vergelykings, woordvergelykings en chemiese vergelykings vir die reaksies te skryf.
In hierdie hoofstuk sal ons een finale tipe reaksie ondersoek, naamlik die reaksie tussen 'n suur en 'n metaal.
Eerstens sal ons 'n ondersoek uitvoer om die reaksie waar te neem en daarna sal ons die vergelykings skryf om dit voor te stel. Voor ons dit egter doen moet ons 'n vinnige ompad loop om iets interessants van waterstof te leer.
Toets vir waterstofgas
Die aktiwiteit stel die toets vir waterstofgas bekend. Dit is opsioneel, maar die toets sal in die volgende ondersoek verder aandag geniet, en as jy dus nie die aktiwiteit in die klas doen nie, is die aanbeveling dat jy leerders aanmoedig om dit op hulle eie tyd te doen, of verduidelik die waterstoftoets voor daar voortgegaan word met die ondersoek.
Waterstof is 'n diatomiese gas. Wat beteken dit?
Dit beteken dat elke molekule bestaan uit twee H atome.
Waterstof kan gevind word in die hoek links bo in die Periodieke Tabel.
Die posisie van waterstof in die Periodieke Tabel dui aan dat dit die ligste van al die elemente is. Dit het die kleinste atoommassa. Omdat die element waterstof 'n gas is (al is dit 'n diatomiese gas), het dit een van die laagste digthede van enige stof. Kan jy onthou wat digtheid beteken? Skryf hieronder jou definisie.
Digtheid is die massa van 'n stof in 'n gegewe ruimte (volume).
Wanneer waterstof in 'n reaksie vrygestel word sal dit dadelik styg, want waterstof se digtheid is minder as dié van lug. As jy 'n ballon met waterstof sou vul, sou dit opwaarts dryf, en mens sou dan 'n toutjie daaraan moet bind en dit vashou om te voorkom dat dit wegdryf.

Nog 'n interessante eienskap van waterstof is dat dit plofbaar met suurstof reageer as dit naby 'n vlam gebring word. Moontlik onthou jy dit uit jou kennismaking met reaksies van nie-metale met suurstof in Hoofstuk 4. Die reaksie tussen 'n groot hoeveelheid waterstof en suurstof lewer 'n pragtige vuurbal en 'n baie harde knal. Onthou jy dat jy die volgende diagram gesien het?
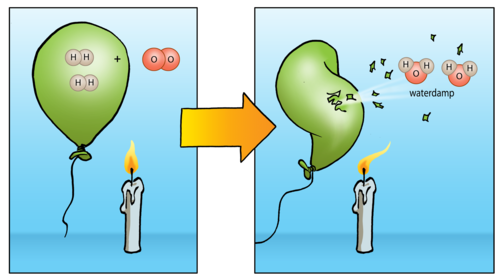
Skryf hieronder die gebalanseerde vergelyking vir die reaksie tussen waterstof en suurstof.
2H2 + O2→ 2H2O
Die reaksie tussen 'n klein hoeveelheid waterstof en suurstof in die lug lewer 'n kenmerkende plof geluid en dit dien as 'n toets vir teenwoordigheid van waterstof. Jy kan kyk na die kort video in die besoek-boksie in die kantlyn om hierdie plof te sien.

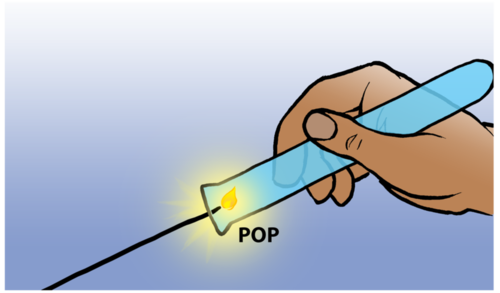
Toetsing vir waterstofgas
'n Sinoniem vir waterstof is 'hidrogeen'. Dit kom van die Griekse woorde vir water'hidro' en vir gebore 'geen' aldus is hidrogeen 'n stof wat aan water geboorte gee.
Kom ons ondersoek nou die reaksie tussen 'n suur en 'n metaal. Jy moet aandagtig luister vir die plofgeluid tydens die ondersoek. As jy dit hoor, is dit 'n teken van die teenwoordigheid van waterstof.
Die reaksie tussen magnesium en soutsuur.
Dit word aanbeveel dat die reaksie aan leerders gedemonstreer word. Daar is baie maniere om die demonstrasie uit te voer; as jy 'n beproefde metode ken, pas dit toe. Byvoorbeeld, 'n eenvoudige metode is om verdunde HCl in 'n proefbuis te plaas, 'n stukkie magnesium by te voeg en dan 'n gloeiende splinter by die bek van die buis te hou sodat die 'plof' hoorbaar is wanneer die waterstof ontwikkel. Hierdie metode is eenvoudig en vereis niks ingewikkelds nie. Dit het die addisionele, prettige bonus om waterstofborrels te maak en hulle te laat ontplof met 'n kersvlam.
Die doel van hierdie ondersoek is om:
- die reaksie tussen soutsuur en magnesium waar te neem, en
- die gasproduk wat tydens die reaksie tussen soutsuur en magnesium gevorm word, te identifiseer.
Jou onderwyser sal die reaksie tussen magnesium en soutsuur demonstreer terwyl jy waarnemings maak.
ONDERSOEKENDE VRAAG:
Een moontlike vraag sal wees: Watter produkte sal vorm wanneer magnesium reageer met soutsuur?
HIPOTESE:
Sommige idees
- Wanneer magnesium reageer met soutsuur, word 'n gas vrygestel.
- Wanneer magnesium reageer met soutsuur, word waterstofgas vrygestel.
MATERIALE:
- magnesiumlint (in kleinerige stukkies opgesny)
- soutsuur (HCl) oplossing (1 M)
- groot proefbuis
- retortstaander met klem
- rubberprop met kort glaspypie daarin gedruk
- silikoon- of rubberpyp (of 'n glas-leweringbuis soos in die opstelling onder getoon)
- vlak bakkie met seepwater gevul (gemaak deur 'n paar teelepels opwasmiddel met water te meng)
Om verdunde soutsuur te berei, voeg stadig en versigtig ongeveer 100 ml gekonsentreerde soutsuur (\(\text{33}\)% of 11 M) by 900 ml koue kraanwater. Gebruik 'n veiligheidsbril en beskermende handskoene gedurende hierdie stap en spoel alle gemorste suur met koue kraanwater weg. Aangesien dit net 'n kwalitatiewe eksperiment is, is dit nie nodig om gedistilleerde water te gebruik nie. Die volumes hoef ook nie met groot akkuraatheid gemeet te word nie. Wees versigtig wanneer die oplossing gehanteer word; selfs die verdunde oplossing kan velskade meebring.
Die hoeveelhede vir die eksperiment is soos volg: 1 g magnesium sal ongeveer 42 ml 1 M soutsuur vereis om opgebruik te word. Net meer as 900 ml waterstofgas sal geproduseer word deur hierdie hoeveelhede reaktante.
METODE:
aan.
Die pH van 1 M HCl is onder 1. Aangesien hierdie oplossing steeds baie korrosief is, word aanbeveel dat jy een verantwoordelike leerder aanwys om die pH-meting namens die klas te maak.
- Stel die eksperiment op soos in die volgende diagram getoon. Maak seker dat die einde van die leweringsbuis onder die oppervlak van die seepoplossing in die bakkie is.
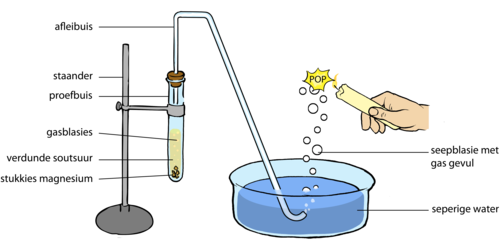
'n Moontlike uitbreiding is om 'n koue stukkie metaal of glas te hou bo die punt waar jy die borrels bars, sodat die waterdamp wat tydens die reaksie gevorm word, op die metaal of glas kondenseer.
- Plaas ongeveer 1 g van die magnesiumstukkies in die proefbuis, maar moet nie die soutsuur byvoeg voor al die ander noodsaaklikhede gereed is nie.
- Voeg ongeveer 40 ml van die verdunde soutsuur by die magnesium in die proefbuis en plaas die prop daarop. Die eerste paar borrels gas wat deur die leweringsbuis kom sal lug wees.
- Wanneer die seepborrels begin opstyg, hou 'n brandende kers daarby en luister versigtig vir die klank wat ontstaan wanneer hulle ontplof. Moenie die kers by die end van die leweringsbuis hou nie.
- Wanneer die magnesium ophou om te reageer en geen verdere borrels vrygestel word nie, blus die kers en plaas dit eenkant.
- Haal die eksperimentele apparaat uitmekaar en toets die pH van die mengsel. Teken die pH aan.
RESULTATE EN WAARNEMINGS:
Teken jou resultate aan in die volgende tabel:
pH van die 1 M soutsuur voor die reaksie | |
pH van die mengsel na die reaksie |
Leerders behoort op te let dat daar 'n plofgeluid is wanneer die kers die borrels laat bars. Hulle behoort ook op te let dat wanneer die HCl by die magnesiumstukkies gevoeg word, die oplossing borrel weens gasontwikkeling.
GEVOLGTREKKINGS:
Watter gevolgtrekkings kan van die resultate van jou ondersoek gemaak word? Herskryf jou hipotese, maar verander dit om jou bevindings weer te gee as dit verskil van wat jy vroeër voorspel het.
VRAE:
Borrels het op die oppervlak van die magnesiumstukkies gevorm.
Borrels het by die end van die buis gevorm.
Die gas in die seepborrels is minder dig as lug. NOTA: Leerders kan dalk sê 'ligter' as lug; jy kan dus die kans gebruik om hulle daaraan te herinner dat minder digte stowwe sal dryf op stowwe met 'n hoër digtheid.
Waterstofgas (H2). Waterstofgas is minder dig as lug en daarom het dit die seepborrels opwaarts laat dryf, wat dan 'n kenmerkende plofgeluid gemaak het wanneer hulle naby die kersvlam gekom het.
Die pH het toegeneem.
As die pH toeneem beteken dit dat daar minder suur in die oplossing is. Die soutsuur is dus tydens die reaksie met die magnesium opgebruik.
Leerderafhanklike antwoord.
In die ondersoek het soutsuur met magnesium ('n metaal) gereageer. Ons taak is om 'n vergelyking vir die reaksie te skryf. Ons sal begin deur 'n algemene vergelyking te skryf en eindig met een wat pas by die reaksie wat ons pas ondersoek het.
Algemene vergelyking vir die reaksie van 'n suur met 'n metaal
Die algemene woordvergelyking vir die reaksie tussen 'n suur en 'n metaal is:
suur + metaal → sout + waterstofgas
Die soort sout wat gevorm word hang af van die spesifieke metaal en suur wat in die reaksie gebruik word.
'n Video en simulasie wat ons meer leer oor die reaksie van sure met metale http://www.bbc.co.uk/bitesize/ks3/science/chemical_material_behaviour/acids_bases_metals/activity/
Vergelykings vir die reaksie tussen magnesium en soutsuur
Kom ons skryf nou vergelykings vir die werklike reaksie vir die jongste ondersoek.
Die skryf van die chemiese vergelyking
Die volgende stappe sal jou lei:
HCl
Magnesium (Mg)
H2
Skryf wat oorbly van die suur (HCl) nadat ons die H weggeneem het en H2 gemaak het. (Onthou dat ons twee H's nodig het om een H2) te maak.
2 Cl
MgCl2
-
Kom ons skryf nou die reaksie, eerste die reaktante, dan die produkte:
2 HCl + Mg → MgCl2+ H2
Stel nou vas of die vergelyking gebalanseer is.
Hoeveel H links en regs? Is hulle gebalanseer?2 H links en 2 H regs. Die H's is gebalanseer.
Hoeveel Cl links en regs? Is hulle gebalanseer?2 Cl links en 2 Cl regs. Die Cl's is gebalanseer.
Hoeveel Mg links en regs? Is hulle gebalanseer?1 Mg links en 1 regs. Die Mg's is gebalanseer.
Aangesien die getalle van elke atoomsoort aan elke kant van die vergelyking dieselfde is, is die vergelyking gebalanseer.
Laastens, kom ons gebruik die chemiese vergelyking om 'n woordvergelyking vir die reaksie te skryf:
soutsuur + magnesium → magnesiumchloried + waterstofgas
Coke blikkies wat gemaak is van aluminium ('n metaal) reageer met 'n suur en 'n basis (video)
Chemikus of Apteker?
Hierdie afdeling is nie vir assesseringsdoeleindes nie en jy mag lus wees om dit uit te laat. Ons wil jou egter sterk aanmoedig om jou leerders die geleentheid te gee om die toepassings van wat hulle in die klas leer in die wêreld buite te ontdek, selfs al is dit net 'n tuiswerk-oefening. Dit is belangrik dat leerders sal besef dat dit wat hulle in die klas leer strek tot buite die mure van die skool. Moedig hule aan om nuuskierig te wees!
Wanneer mense hoor dat iemand 'n 'chemikus' is, verwar hulle dit dikwels met 'n 'apteker'. In sommige lande word die terme 'chemikus' en 'apteker' gebruik om dieselfde soort persoon te beskryf. In Suid-Afrika het die twee woorde verskillende betekenisse. Maar wat is dan die twee betekenisse?
Doen naslaanwerk om die verskille tussen die beroepe 'chemikus' en 'apteker' te identifiseer, en som dit op.
-
Chemici:
Chemici is mense wat chemie bestudeer het en hulle gespesialiseerde kennis van chemiese reaksies gebruik om nuwe verbindings en materiale te maak. Dit kan wees nuwe medisynes, innoverende boumateriale, nuwe brandstowwe wat nie die omgewing skaad nie en baie ander stowwe.

-
Aptekers:
Aptekers bestudeer ook chemie, maar kombineer dit met ander vakke soos farmakologie, fisiologie en biochemie. Aptekers is gesondheidspesialiste en kry as sulks spesialisopleiding in die gesondheidswetenskappe sowel as die chemiese wetenskap. Hulle kern-verantwoordelikheid is om die veilige en effektiewe gebruik van medisynes te verseker. Hulle gebruik hulle kennis van medisynes en die menslike liggaam om voorskrifte in 'n gelisensieerde apteek te resepteer. Werkgeleenthede vir aptekers sluit ook in kliniese dienste, toesig oor medisynes vir hulle veiligheid en effektiwiteit en die voorsiening van medisinale inligting waar dit nodig is.

Ander loopbane in chemie
Hierdie is 'n opsionele aktiwiteit; dit is nie vir assessering nie. Die aanbeveling is dat jy die leerders sal aanmoedig om dit buite die klas te doen as jy nie klastyd daarvoor kan afstaan nie, aangesien dit vir hulle belangrik is om te weet waarheen chemie uiteindelik kan lei.
'n Nuttige adres om meer te wete te kom van chemie-verwante loopbane http://www.acs.org/content/acs/en/careers/whatchemistsdo/careers.html
INSTRUKSIES:
- Hieronder is 'n lys van verskillende loopbane wat almal chemie op die een of ander manier betrek. Kyk na die lys en kies dan die vyf loopbane wat jy die interessantste vind.
- Voer 'n internetsoektog uit om uit te vind wat elke loopbaan behels.
- Gee 'n enkelreëlbeskrywing van die loopbaan.
- Indien daar 'n loopbaan is wat jou interesseer, teken 'n glimlag-gesiggie langsaan en doen 'n bietjie ekstra moeite om op te lees oor die onderwerp en waarheen chemie jou kan neem! Vind uit watter vlak van chemie nodig is vir die bepaalde loopbaan.
- Daar is baie chemie-loopbane behalwe die genoemdes wat chemie benut. As jy dus van so iets weet en wat jou interesseer, doen moeite om die moontlikhede na te speur.
Sommige loopbane wat chemiekennis vereis:
- Landbouchemie
- Biochemie
- Biotegnologie
- Chemie-opleiding en -onderwys
- Tandarts
- Omgewingschemie
- Forensiese chemie
- Voedselwetenskap en -tegnologie
- Genetikus
- Geochemie
- Materiaalwetenskap
- Medisyne en medisinale chemie
- Mynwese
- Olie- en petroleumindustrie
- Organiese chemie
- Oseanografie
- Patentreg
- Farmaseutika
- Ruimte-eksplorasie
- Soölogie
Jou beskrywing van die loopbane waaarin jy belangstel:
Beroemde wetenskaplikes (insluitend chemici) is oplettend, nuuskierig, geduldig en gretig om elke dag meer te weet van hulle vakgebied.
In hierdie hoofstuk het ons die reaksie van soutsuur met magnesium ondersoek as 'n voorbeeld van 'n reaksie tussen 'n metaal en 'n suur.
10 redes om dol te wees oor wetenskap! (video)
Opsomming
- 'n Suur sal met 'n metaal reageer om 'n sout en waterstofgas te vorm.
- Die algemene woordvergelyking vir die reaksie tussen 'n suur en 'n metaal is soos volg:
-
suur + metaal → sout + waterstof
-
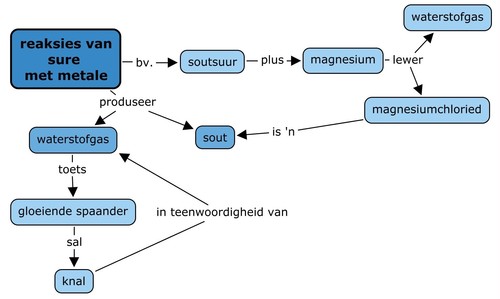
Konsepkaart
Hierdie was 'n taamlike kort hoofstuk, dus is die begripskaart oop gelos vir jou om self te voltooi. Maak seker dat jy iets oor die toets vir waterstof insluit.

Hierdie is 'n voorbeeld van wat die leerders mag aanbied:
Hersieningsvrae
Vul die ontbrekende woorde in die volgende sinne in. Skryf die woord op die reël onder. [3 punte]
-
Wanneer 'n suur reageer met 'n metaal, word 'n sout en _____ gas gevorm.
-
'n Molekule wat bestaan uit twee atome wat verbind is, word 'n _____ molekule genoem.
-
Die wetenskaplike omvang wat verteenwoordig word deur die massa van 'n stof in 'n gegewe volume word die _____ van daardie stof genoem.
- waterstof
- diatomiese
- digtheid
Leerders se paragraaf moet ten minste die volgende bevat:
- Waterstofgas se digtheid is laer as die van lug.
- Stowwe van 'n lae digtheid sal altyd dryf op stowwe van 'n hoër digtheid.
Leerders se paragraaf moet ten minste die volgende bevat:
- Die eerste teken waarvoor ons op die uitkyk moet wees is borrels. Die teenwoordigheid van borrels dui aan dat 'n gas gedurende die reaksie gevorm word.
- Om te bevestig dat die gas waterstof is, vang 'n klein hoeveelheid op in 'n proefbuis. Hou 'n gloeiende splinter by die bek van die buis wanneer jy die gas vrylaat. As die gas met 'n kenmerkende plofgeluid ontbrand, sal ons weet dit is waterstof.
Die pH sal toeneem. In die reaksie word die suur na iets anders omgesit wat nie 'n suur is nie. Dit beteken die pH moet toeneem.
Voltooi die volgende tabel deur die ontbrekende vergelykings te gee vir die reaksie tussen soutsuur en magnesium. [6 punte]
Woordvergelyking | |
Chemiese vergelyking | |
Algemene vergelyking |
Woordvergelyking | soutsuur + magnesium → magnesiumchloried + waterstofgas |
Chemiese vergelyking | 2 HCl + Mg → MgCl2 + H2 |
Algemene vergelyking | suur + metaal → sout + waterstof |
Voltooi die vogende tabel deur die ontbrekende vergelykings te voorsien vir die reaksie tussen soutsuur en sink. [4 punte]
Woordvergelyking | |
Chemiese vergelyking | 2 HCl + Zn → ZnCl2 + H2 |
Algemene vergelyking |
Woordvergelyking | soutsuur + sink → sinkchloried + waterstofgas |
Chemiese vergelyking | 2 HCl + Zn → ZnCl2 + H2 |
Algemene vergelyking | suur + metaal → sout + waterstof |
Ons het in hierdie kwartaal gekyk na baie verskillende chemiese reaksies. As 'n opsomming, voltooi die volgende tabel deur in die tweede kolom die algemene vergelykings in woorde te gee vir elk van die chemiese reaksies, en gee 'n voorbeeld van elke tipe as 'n gebalanseerde chemiese vergelyking in die derde kolom. [18 punte]
Tipe chemiese reaksie | Algemene woordvergelyking | Voorbeeld (gebalanseerde vergelyking) |
metale met suurstof | ||
nie-metale met suurstof | ||
sure met metaaloksiede | ||
sure met metaalhidroksiede | ||
sure met metaalkarbonate | ||
sure met metale |
Net een voorbeeld is in hierdie tabel gegee van wat leerders as 'n voorbeeld sou kon aanbied. Daar is egter ook ander geskikte reaksies waarvan hulle in hierdie kwartaal geleer het. Jy moet nagaan of die reaksies wat hulle aanbied gebalanseer is.
Die puntetoekenning is 1 punt vir elk van die woordvergelykings en 2 punte vir die voorbeeld (net 1 punt as dit nie korrek gebalanseer is nie).
Tipe chemiese reaksie | Algemene woordvergelyking | Voorbeeld (gebalanseerde vergelyking) |
metale met suurstof | metaal + suurstof → metaaloksied | 2Mg + O2→ 2MgO |
nie-metale met suurstof | nie-metaal + suurstof → nie-metaaloksied | C + O2→ CO2 |
sure met metaaloksiede | suur + metaaloksied → sout + water | 2HCl + MgO → MgCl2 + H2O |
sure met metaalhidroksiede | suur + metaalhidroksied → sout + water | HCl + NaOH → NaCl + H2O |
sure met metaalkarbonate | suur + metaalkarbonaat → sout + koolstofdioksied + water | 2HCl + CaCO3→ CaCl2 + CO2 + H2O |
sure met metale | suur + metaal → sout + waterstofgas | 2HCl + Mg → MgCl2 + H2 |
Totaal [38 punte]



