'n Moontlike antwoord: Wat sal met die pH van die oplossing gebeur as ons asyn by koeksoda voeg?
Reaksies van sure met basisse
Hoofstuk oorsig
2 weke
Die sentrale uitdaging van hierdie hoofstuk is om vas te lê dat suur-basisreaksies ruilreaksies is. 'n Fragment van die suur word met 'n fragment van die basis uitgeruil en 'n sout en water is die produkte van die reaksie. Die tipe sout wat vorm hang af van die identiteite van die suur en die basis wat gedurende die reaksie saamgevoeg is.
As leerders dit eers begryp, het hulle 'n belangrike tree geneem in die verstaan van suur-basischemie. Ons sal aan die begin van die hoofstuk tyd bestee aan die ontwikkeling van 'n raamwerk om dit te verduidelik, en dikwels daarna terugkeer.
In die lig van die feit dat leerders nog nie van katione en anione geleer het nie, het ons gedink dat dit pedagogies verantwoordbaar is om die volgende vereenvoudigings te maak ten opsigte van aanvaarde suur-basisteorie, ten einde die konsep van ruiling aan die leerders oor te dra:
-
Sure kan beskou word dat hulle H bydra (in plaas van H+); en
-
Basisse kan beskou word dat hulle O of OH bydra (in plaas van O2- en OH-).
-
Water (H2O) is 'n kombinasie van 2 H en 1 O, of alternatiewelik 1 H en 1 OH.
Ons is deeglik bewus daarvan dat die skryfwyse H + OH → H2O geen wetenskaplike betekenis het nie en ons het dit daarom in die teks vermy. Maar ons is wel van mening dat die gebruik van vereenvoudigde simbole (H in plaas van H+ ensovoorts) in hierdie konteks 'n voordeel het bo die wetenskaplik korrekte (maar moontlik verwarrende) alternatiewe.
Daar is ook 'n gevaar dat hierdie vereenvoudiging later tot wanbegrippe en slordige gebruik van simbole kan lei. Maar ons voel tog dat hierdie risiko's opgeweeg moet word teen die groter waarskynlikheid dat leerders die konsep van ruiling verstaan, as die simbole waarmee hulle werk nie vol ekstra inligting is - soos die ladings op die ione - wat nog nie vir hulle enige betekenis het nie.
Ander vaardighede wat in hierdie hoofstuk versterk sal word, is:
- die skryf van chemiese formules;
- omskakeling tussen woordvergelykings en chemiese vergelykings; en
- die balansering van chemiese vergelykings.
'n Woord van waarskuwing: Suur-basisreaksies is neutralisasiereaksies. Dit beteken egter nie dat 'n mengsel van 'n suur met 'n basis 'n neutrale oplossing sal wees nie en jy moet taal wat hierdie opvatting sou versterk, vermy. Selfs al word ekwivalente hoeveelhede (stoïgiometriese hoeveelhede) van die suur en die basis gemeng - wat sou impliseer dat albei geneutraliseer is - sal die resulterende oplossing slegs onder baie spesiale omstandighede neutraal (d.w.s. pH = 7) wees. Die rede is dat nie alle soute 'neutrale stowwe' is nie; in werklikheid het die meeste soute suur-basiseienskappe van hul eie. Die chemie wat vereis word vir leerders om dit te verstaan, is in hierdie stadium bo hul vermoë en sal eers in Fisiese Wetenskappe in Graad 12 behandel word. Ons stel voor dat jy eenvoudig net nie soute 'neutrale stowwe' noem nie. Indien vrae oor hierdie kwessie opduik, sou jy daarop kon wys dat die soute wat hulle in hierdie hoofstuk sal teëkom dalk neutrale stowwe mag wees, maar dat dit nie vir alle soute geld nie.
Let daarop dat alhoewel daar nie 'n spesifieke afdeling genaamd 'Toepassings' is soos in KABV aangedui nie, word hierdie inhoud eerder in ander afdelings waar dit meer toepaslik is, behandel.
6.1 Neutralisasie en pH (1.5 ure)
Take | Vaardighede | Aanbeveling |
Ondersoek: Die reaksie tussen asyn en koeksoda | Stel van hipotese, meting, voorbereiding, waarneming, vergelyking, notering, trek van grafieke | KABV voorgestel |
Aktiwiteit: CO2 deur water borrel | Waarneming, meting, vergelyking | Opsioneel |
Aktiwiteit: Wat is suurreën? | Waarneming, lees, navorsing, interpretering, analisering, opsomming | KABV voorgestel |
6.2 Die algemene reaksie van 'n suur met 'n metaaloksied (1.5 ure)
Take | Vaardighede | Aanbeveling |
Ondersoek: Die reaksie tussen magnesiumoksied en soutsuur | Stel van hipotese, voorbereiding, waarneming, meting, notering, trek van grafieke | KABV voorgestel |
Aktiwiteit: Skryf van die chemiese vergelyking | Skryf en balansering van chemiese vergelykings | Opsioneel (Voorgestel) |
6.3 Die algemene reaksie van 'n suur met 'n metaalhidroksied (1.5 ure)
Take | Vaardighede | Aanbeveling |
Ondersoek: Die reaksie tussen natriumhidroksied en soutsuur | Stel van hipotese, voorbereiding, meting, waarneming, meting, notering, trek van grafieke | KABV voorgestel |
Aktiwiteit: Skryf van die chemiese vergelyking | Skryf en balansering van chemiese vergelykings | Opsioneel (Voorgestel) |
6.4 Die algemene reaksie van 'n suur met 'n metaalkarbonaat (1.5 ure)
Take | Vaardighede | Aanbeveling |
Ondersoek: Die reaksie tussen kalsiumkarbonaat (bordkryt) en soutsuur | Stel van hipotese, voorbereiding, vergelyking, meting, notering, trek van grafieke | KABV voorgestel |
Aktiwiteit: Skryf van die chemiese vergelyking | Skryf en balansering van chemiese vergelykings | Opsioneel (Voorgestel) |
- Wat word die reaksie tussen 'n suur en 'n basis genoem?
- Wat gebeur met die pH wanneer 'n suur en 'n basis gemeng word?
- Gee die reaksie tussen 'n suur en 'n basis altyd 'n neutrale mengsel, met ander woorde 'n mengsel met pH = 7?
- Watter faktore sal die pH van die finale oplossing bepaal wanneer 'n suur en 'n basis gemeng word?
- Is daar 'n manier om te voorspel watter klasse van verbindings geneig sal wees om sure te wees en watter basisse?
- Is metaaloksiede, metaalhidroksiede en metaalkarbonate suur of basies? In watter pH-gebied sal hul oplossings val?
- Watter produkte kan ons verwag as 'n metaaloksied, 'n metaalhidroksied of 'n metaalkarbonaat met 'n suur reageer?
- Is daar algemene vergelykings om hierdie reaksies mee weer te gee?
- Hoe vorm suurreën?
Neutralisasie en pH
- neutralisasiereaksie
- neutraliseer
- neutrale oplossing
- sterkte
- ompad
- ruilreaksie
- laboratoriumsure
- korroderend
- suurreën
Ons het in die vorige hoofstuk kennis gemaak met 'n nuwe konsep, naamlik pH. As ons wil weet of iets 'n suur of 'n basis is, kan ons sy pH meet:
- Sure het pH-waardes onder 7. Hoe laer die pH-waarde, hoe sterker suur is die stof.
- Basisse het pH waardes bokant 7. Hoe hoër die pH-waarde, hoe sterker basies is die stof.
- Neutrale stowwe het pH gelyk aan 7.
Nog iets nuttigs wat ons in die vorige hoofstuk geleer het, was dat ons universele indikator kan gebruik om die pH van 'n oplossing te meet. Universele indikator het verskillende kleure by verskillende pH-waardes. Hier onder is 'n kleurkaart wat die reeks kleure vir universele indikator en hul ooreenstemmende pH-waardes toon. Jy sal dit vir al die aktiwiteite van hierdie hoofstuk benodig, want ons gaan baie pH-metings doen!

Kan jy onthou hoe ons die universele indikatorpapier in die vorige hoofstuk gebruik het? Hier is 'n paar voorstelle vir die ondersoeke van hierdie hoofstuk:
- Voordat jy begin, plaas eers 1-cm lengtes universele indikatorpapier op 'n vel wit papier, soos hier getoon:
Later, as jy 'n aantekening of 'n waarneming wil neerskryf, kan jy dit direk op die papier doen en dit agterna in jou werkboek oorskryf.
-
In plaas daarvan om die papier in die oplossings wat jy toets te doop, kan jy 'n glasstaaf of drinkstrooitjie gebruik om 'n druppel van die toetsoplossing na die indikatorpapier oor te bring.
In sommige van die ondersoeke in hierdie hoofstuk sal julle druppers of spuite gebruik om hoeveelhede uit te meet. Sê aan die leerders dat die druppers en spuite nie gebruik mag word om ander leerders met water te spuit nie! Daar is baie redes waarom dit nie 'n goeie idee is nie. Die belangrikste rede is dat die drupper of spuit suur mag bevat, wat in iemand se oog kan beland waar dit permanente skade of selfs blindheid kan veroorsaak. Dus word 'n gespuit met druppers of spuite nie toegelaat nie.
Wat is neutralisasie?
Wat dink jy sal gebeur as ons 'n suur en 'n basis meng?
Laat leerders dit in die klas of in klein groepe bespreek. Laat hulle toe om daaroor te bespiegel en lei hulle terug na hul Graad 7 werk: 'n Suur sal sy sterkte verloor wanneer dit met 'n basis gemeng word, en omgekeerd. Die suur sal dus verswak word deur die basis en die basis sal deur die suur verswak word. 'Verswak', is egter 'n term wat liefs vermy moet word, want 'swak' en 'sterk' het spesifieke betekenisse wanneer sure en basisse ter sprake is. In 'n sekere sin sal hul suur-basiseienskappe vernietig word, want hulle sal omgesit word na produkte wat nie sure of basisse is nie. (Die sout wat uit die reaksie tussen 'n suur en 'n basis ontstaan, het dikwels suur-basiseienskappe van sy eie, maar ons gaan dit nie nou bespreek nie.)
Ons gaan 'n ondersoek doen om uit te vind. Ons gaan asyn en koeksoda meng. Maar kom ons hersien eers: is asyn 'n suur of 'n basis? As jy twyfel, verbeel jou jy sit 'n druppel asyn op jou tong. Hoe sal dit proe?
Dit sal suur smaak, dus is dit 'n suur.
Is koeksoda 'n suur of 'n basis? As jy twyfel kan jy terugblaai na die vorige hoofstuk en kyk na die aktiwiteit 'Die pH-skaal'.
Koeksoda is 'n basis.
Die reaksie tussen asyn en koeksoda
Hoeveelhede vir hierdie ondersoek is as volg: Elke 1 g koeksoda sal ongeveer 15 ml asyn vir volledige neutralisasie benodig. Ons stel voor dat jy 1 teelepel koeksoda en ongeveer 50 ml asyn vir elke groep uitmeet.
Die doel van hierdie eksperiment is om te ondersoek hoe die pH verander wanneer asyn by koeksoda gevoeg word.
ONDERSOEKENDE VRAAG(E):
OORSIG VAN DIE ONDERSOEK:
In die gebied pH > 7
Die pH sal toeneem.
HIPOTESE:
Wanneer ons asyn by koeksoda voeg, sal die pH van die mengsel afneem.
MATERIALE:
- koeksoda
- asyn
- water
- glasbeker of klein jogurtbakkie
- universele indikatorpapier (in 1-cm strokies geknip)
- vel wit drukkerpapier
- plastiek teelepel
METODE:
- Berei die universele indikatorpapier voor deur vyf 1-cm stukkies netjies onder mekaar op die vel papier te plaas.
- Plaas een teelepel koeksoda in die beker of jogurtbakkie.
- Voeg ongeveer 10 teelepels water by die koeksoda.
- Gebruik die teelepel om die oplossing te roer totdat al die koeksoda opgelos het. Ons gaan dit van nou af die toetsoplossing noem.
- Bring een druppel van die toetsoplossing oor op die eerste stukkie universele indikatorpapier met behulp van die teelepel of 'n drinkstrooitjie.
- Vergelyk die kleur van die papier met die kleurgids wat aan die begin van die hoofstuk gegee is, om die pH van die oplossing vas te stel. Teken hierdie pH aan in jou resultaattabel.
- Voeg 1 teelepel asyn by die toetsoplossing. Roer dit versigtig en bring nog 'n druppel van die oplossing oor op 'n vars strokie universele indikator.
- Lees die pH van die oplossing van die kleurgids af en noteer dit in jou resultaattabel.
- Herhaal stappe 6 en 7 totdat die pH van die toetsoplossing onder 7 val. Jy mag dalk meer as 5 stukke universele indikatorpapier benodig.
RESULTATE:
Rapporteer jou resultate in 'n netjiese tabel. Gebruik gepaste opskrifte vir jou tabel. 'Aantal teelepels asyn bygevoeg' en 'Kleur van die universele indikatorpapier' en 'pH van die toetsoplossing' is voorgestelde opskrifte vir jou kolomme.
Trek 'n lyngrafiek om jou resultate te illustreer. Wat sal op die x-as wees en wat sal op die y-as wees? Gee jou grafiek 'n opskrif.
Leerders moet 'n grafiek trek met die 'aantal teelepels asyn bygevoeg' op die x-as (onafhanklike veranderlike) en die pH van die oplossing op die y-as (afhanklike veranderlike).
GEVOLGTREKKINGS:
Watter gevolgtrekkings kan van die resultate van jou ondersoek gemaak word? Hier kan jy jou hipotese oorskryf, maar verander dit om jou bevindinge weer te gee indien hulle verskil van dit wat jy vroeër voorspel het.
Kon jy jou hipotese bevestig of verwerp?
In hierdie ondersoek het jy waarskynlik opgelet dat die pH van die mengsel afgeneem het met elke byvoeging van nog asyn by die koeksoda! Waarom het dit gebeur?
Wanneer 'n suur en 'n basis gemeng word (in die regte hoeveelhede), sal hulle mekaar neutraliseer. Dit beteken dat hulle saam in iets sal verander wat nóg 'n suur nóg 'n basis is. Dus sal die suur en basis albei hulle onderskeidende kenmerke van suur en basisiteit verloor.
Wat het ons tot dusver geleer? Ons het geleer dat sure en basisse mekaar neutraliseer.
-
As ons 'n basis by 'n suur voeg, sal die pH van die resulterende oplossing toeneem, want die suur sal van sy sterkte verloor.
- As ons 'n suur by 'n basis voeg, sal die teenoorgestelde gebeur. Die pH sal afneem, want die basis verloor van sy sterkte.
Wat is die produkte van 'n suur-basisreaksie? Kan ons voorspel wat hulle sal wees?
Die produkte van suur-basisreaksies
Ten einde te kan verstaan hoe 'n suur-basisreaksie werk, moet ons 'n vinnige ompad neem en iets sê oor ruilreaksies. Suur-basisreaksies is ruilreaksies.
In die onderstaande reaksie ondergaan twee stowwe AB en CD 'n ruilreaksie:
AB + CD → AD + CB
Kan jy sien dat A en C maats geruil het sodat A nou verbind is met D, terwyl C verbind is met B?
Wat het dit met sure en basisse te doen? Wel, sure en basisse ondergaan ook ruilreaksies. Hier is 'n paar voorbeelde. Kyk of jy kan uitwerk watter dele met watter uitgeruil het.
Voorbeeld 1
HCl + NaOH → NaCl + HOH
In die bostaande vergelyking moet HOH eintlik geskryf word as: H2O. Die reaksievergelyking word:
HCl + NaOH → NaCl + H2O
of, in woorde:
soutsuur + natriumhidroksied →natriumchloried + water
In hierdie voorbeeld het die volgende gebeur:
- die suur het sy H geskenk vir die maak van 'n watermolekule;
- die basis het OH gegee vir die maak van 'n watermolekule; en
- die Na van die basis en die Cl van die suur het saamgekom om 'n sout te vorm.
Voorbeeld 2
2 HCl + MgO → MgCl2 + HOH
In die bostaande vergelyking moet HOH eintlik geskryf word as: H2O. Die reaksievergelyking word:
2 HCl + MgO → MgCl2 + H2O
of, in woorde:
soutsuur + magnesiumoksied →magnesiumchloried + water
In hierdie voorbeeld het die volgende gebeur:
- die suur het 2 H's gegee vir die maak van 'n watermolekule;
- die basis het OH gegee vir die maak van 'n watermolekule; en
- die Mg van die basis en die 2 Cl'e van die suur het saamgekom om 'n sout te vorm.
Suur-basisreaksies lewer altyd 'n sout en water. In albei bostaande voorbeelde was die algemene vergelyking:
suur + basis → sout + water
Daar is een klas van suur-basisreaksies wat 'n addisionele produk lewer, maar ons sal later meer daaroor leer.
Jy sal in Graad 11 leer dat die meganismes van hierdie reaksies in werklikheid ietwat meer kompleks is, maar dit is vir eers goed genoeg om dit op hierdie vlak te verstaan.
Van watter laboratoriumsure moet ons weet?
Toe ons sure en basisse in die vorige hoofstuk ondersoek het, het ons slegs huishoudelike sure soos suurlemoensap en asyn in ag geneem. Daar is 'n paar laboratoriumsure waarvan jy die name en formules moet ken en hulle word in die volgende tabel gegee:
Naam van die suur | Formule van die suur |
soutsuur | HCl |
salpetersuur | HNO3 |
swawelsuur | H2SO4 |

Hierdie sure is baie korroderend, selfs wanneer hulle met water verdun is en moet altyd baie versigtig hanteer word.
Wat gebeur wanneer jy 'n burger in sterk soutsuur plaas? (video)
In die volgende afdelings sal ons die klasse stowwe wat tipies sure of basisse is, bespreek.
- Nie-metaaloksiede vorm suuroplossings wanneer hulle in water opgelos word.
- Metaaloksiede, metaalhidroksiede en metaalkarbonate vorm almal basiese oplossings wanneer hulle in water opgelos word.
Ons gaan die nie-metaaloksiede eerste beskou.
Nie-metaaloksiede vorm suuroplossings
Kan jy 'n paar nie-metaaloksiede opnoem? Skryf hulle formules neer. As jy twyfel, kan jy na die Periodieke Tabel loer en 'n paar nie-metale van die regterkant van die tabel kies. Voeg suurstof by en jy het 'n nie-metaaloksied!
CO2 en SO2
Hoe weet ons dat nie-metaaloksiede suuroplossings vorm? Eksperimente het dit bewys.
Jy mag dit dalk nie weet nie, maar wanneer CO2-gas deur water geborrel word, los daarvan in die water op om koolsuur te vorm. Hier is die reaksievergelyking:
CO2 + H2O → H2CO3
Probeer die volgende vinnige aktiwiteit om dit te sien gebeur.
CO2 deur water geborrel
'n Variasie van hierdie aktiwiteit sou wees om indien jy vloeibare universele indikator het, dit aan die begin by die kraanwater te voeg om te wys dat die pH 7 is (dit moet groen wees). Die universele indikator sal dan van kleur verander terwyl jy in die water blaas. Maak seker dat jy 'n deursigtige glas gebruik sodat die leerders die kleurverandering kan sien namate dit meer geel word. Dit sluit aan by die volgende aktiwiteit oor suurreën en hoe dit vorm.
MATERIALE:
- kraanwater
- glas
- drinkstrooitjie
- indikatorpapier
INSTRUKSIES:
Ons sou die pH van die water met universele indikatorpapier kon meet.
-
Blaas nou met die strooitjie in die water. Jou asem bevat CO2 en hiervan sal in die water oplos as jy vir 'n paar minute hiermee aanhou.

Die pH sal onder 7 wees.
Koolsuur word by koeldrank gevoeg om dit te laat bruis. Die koolsuur ontbind en vorm koolstofdioksied (CO2)
Die pH van die oplossing is nou onder 7 omdat dit koolsuur (H2CO3) bevat. Koolsuur is nie 'n baie sterk suur nie, maar steeds suur genoeg om 'n pH laer as 7 te hê.
Wanneer swaweldioksied ('n gas) deur water geborrel word, los dit in water op om 'n suur te vorm wat swawelsuur genoem word:
SO2 + H2O → H2SO3
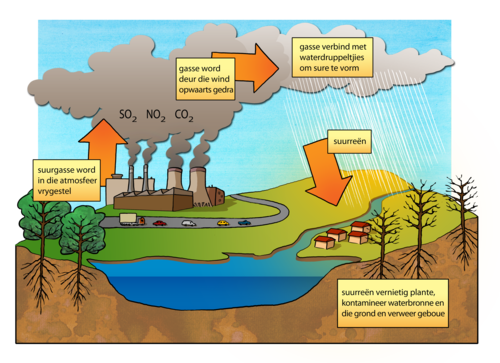
Hierdie is twee van die reaksies wat verantwoordelik is vir verskynsel wat suurreën genoem word. SO2 en CO2 word as afvalstowwe deur fabrieke en kragstasies vrygestel. Brandende hout en fossielbrandstowwe stel byvoorbeeld koolstofdioksied en swaweldioksied in die atmosfeer vry. Hierdie gasse los dan in waterdruppeltjies in die atmosfeer op om sure te vorm, soortgelyk aan die wyse waarop die CO2 in jou asem in die water opgelos het om 'n suuroplossing te vorm in die vorige aktiwiteit. Wanneer dit reën, is hierdie sure aanwesig in die reëndruppels wat terug aarde toe val. Swawelsuur (H2SO3) is sterk genoeg om plantlewe te beskadig en waterbronne suur te maak.


Vir die volgende aktiwiteit moet jy navorsing doen oor suurreën.
Vulkane stel ook nie-metaaloksiede (hoofsaaklik SO2) in die lug vry wat tot suurreën kan bydra.
Wat is suurreën?
INSTRUKSIES:
- Bestudeer die diagram wat toon hoe suurreën gevorm word.
- Doen ekstra leeswerk en navorsing oor suurreën.
- Beantwoord die vrae oor suurreën.
VRAE:
Hulle is swaweldioksied (SO2), koolstofdioksied (CO2) en stikstofdioksied (NO2).
Die hoofbronne van hierdie gasse wat bydra tot suurreën spruit uit menslike aktiwiteite, soos kragopwekking in fossielbrandstof-kragstasies (veral steenkool), fabrieke wat rook afgee en die uitlaatgasse van motorvoertuie. Suurreën kan ook voorkom as gevolg van natuurlike verskynsels, soos vulkane wat swaweldioksied in die atmosfeer afgee. Sommige prosesse in die oseane en in vleilande produseer ook die gasse wat sure vorm.
SO2 + H2O → H2SO3
CO2 + H2O → H2CO3
Swawelsuur en koolsuur.
Die effekte sluit in:
- beskadiging van plantlewe, wildernis sowel as oeste, afhangende van waar die reën val
- die reën syfer in die grond in en maak dit meer suur; dit maak mikroörganismes in die grond dood, beskadig plante verder deur grondwater te kontamineer
- die reën kan in verskeie waterbronne val en ook afloop in waterbronne soos riviere, mere en damme; dit veroorsaak dat die water meer suur word; waterdiere en -plante kan doodgaan; menslike waterbronne word ook té suur
Sure is korrosief en kan dus oppervlakke met verloop van tyd korrodeer.
Leerders moet hul antwoorde verdedig. Hulle mag sê dat dit die plaaslike omgewing help as die gasse verder weggevoer word en dus nie die dorp of stad waarin die fabriek is, besoedel nie. Maar dit doen niks om die suurreën wat potensieel kan vorm, te verminder nie, aangesien dieselfde hoeveelheid gasse steeds afgegee word; hulle word net verder weggevoer. Die suurreën kan dus nog steeds vorm en op plantegroei en areas buite die dorpe en stede val.
Daar is verskeie oplossings om die vorming van suurreën te beperk. So byvoorbeeld kan steenkoolaangedrewe kragstasies filters en ander prosesse in hul rooktorings gebruik om swawelgasse te verwyder voordat die rook in die atmosfeer vrygelaat word. Lande kan groter stappe neem deur ooreenkomste te onderteken om hulle swawel- en ander kweekhuisgas-emissies te verminder. Die beweging om van herwinbare energiebronne gebruik te maak, sal ook help om die afhanklikheid van steenkool en ander fossielbrandstowwe te verminder, en daardeur die vrylating van suur-produserende gasse in die atmosfeer verminder.
Ons het nou van nie-metaaloksiede geleer, maar wat van metaaloksiede? Watter tipe oplossings vorm hulle in water? Ons sal meer oor hulle en ander metaalverbindings in die volgende afdeling uitvind.
Metaaloksiede, metaalhidroksiede en metaalkarbonate vorm basiese oplossings
Metaaloksiede
Kan jy onthou dat jy in Hoofstuk 3 van sommige metaaloksiede geleer het? Ons het reeds hierdie reëls geleer om die formules van metaaloksiede te skryf.
-
Metaaloksiede van groep 1 in die Periodieke Tabel sal die formule M 2O hê.
Kan jy twee voorbeelde skryf? Kyk na die Periodieke Tabel voor in die boek, kies enige twee metale van groep 1 en skryf hulle formules deur hierdie reël te gebruik.
Enige twee van die volgende: Li2O, Na2O, K2O, Rb2O, Cs2O
-
Metaaloksiede van groep 2 sal die formule MO hê.
Kan jy 2 voorbeelde skryf?
Enige twee van die volgende: BeO, MgO, CaO, SeO, BaO
Wat dink jy sal die pH van 'n oplossing van 'n metaaloksied in water wees?
Die pH sal bokant 7 wees.
Die volgende klas van verbindings wat basiese oplossings in water vorm, is die metaalhidroksiede.
Metaalhidroksiede
'n Metaalhidroksied vorm wanneer 'n metaal met water reageer. 'n Metaalhidroksied het die algemene formule MOH of M(OH)2. In die formule verteenwoordig M 'n metaalatoom, O 'n suurstofatoom en H 'n waterstofatoom.
Ten einde te weet of die MOH of M(OH)2 die korrekte formule sal wees, is daar twee eenvoudige reëls om te onthou:
-
Metaalhidriede van groep 1 in die Periodieke Tabel sal die formule MOH hê.
Kan jy twee voorbeelde skryf? Kyk na die Periodieke Tabel voor in die boek, kies enige twee metale van groep 1 en skryf hulle formules deur hierdie reël te gebruik.
Enige twee van die volgende: LiOH, NaOH, KOH, RbOH, CsOH.
-
Metaalhidroksiede van groep 2 sal die formule M(OH) 2 hê.
Kan jy twee voorbeelde skryf?
Enige twee van die volgende: Be(OH)2, Mg(OH)2, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Wat dink jy sal die pH van 'n oplossing van 'n metaalhidroksied in water wees?
Die pH sal bokant 7 wees.
Die laaste klas van verbindings wat basiese oplossings in water vorm is die metaalkarbonate. Koeksoda is 'n spesiale tipe karbonaat wat 'n bikarbonaat(of waterstofkarbonaat) genoem word. Jy sal onthou dat dit een van die basisse was wat ons vroeër met universele indikator getoets het.
Metaalkarbonate
'n Metaalkarbonaat het die algemene formule MCO3 of M2CO3. In die formule verteenwoordig M 'n metaalatoom, C 'n koolstofatoom en O 'n suurstofatoom.
Ten einde te weet of die MCO3 of M2CO3 die korrekte formule sal wees, is daar twee eenvoudige reëls om te onthou:
-
Metaalkarbonate van groep 1 in die Periodieke Tabel sal die formule M2CO3 hê.
Kan jy twee voorbeelde skryf?
Enige twee van die volgende: Li2CO3, Na2CO3, K2CO3,Rb2CO3, Cs2CO3.
-
Metaalkarbonate van groep 2 sal die formule MCO3 hê.
Kan jy twee voorbeelde skryf?
Enige twee van die volgende: BeCO3, MgCO3, CaCO3, SrCO3, BaCO3.
Wat dink jy sal die pH wees van 'n oplossing van 'n metaalkarbonaat in water?
Die pH sal bokant 7 wees
Ons gaan in die volgende afdelings werklike reaksies ondersoek!
Die algemene reaksie van 'n suur met 'n metaaloksied
- metaaloksied
Ons het in die vorige afdeling geleer van twee klasse oksiede, naamlik metaaloksiede en nie-metaaloksiede. Hier is wat ons sover van hulle weet:
- Metaaloksiede word gevorm deur die reaksie tussen 'n metaal en suurstof. Metaaloksiede is basies. Wanneer ons hulle in water oplos, vorm hulle oplossings met pH-waardes bokant 7.
- Nie-metaaloksiede word gevorm deur die reaksie tussen 'n nie-metaal en suurstof. Nie-metaaloksiede is suur. Wanneer hulle in water oplos, vorm hulle oplossings met pH-waardes onder 7.
Hier is dieselfde opsomming, in tabelvorm, met 'n paar voorbeelde bygevoeg:
Metaaloksiede | Nie-metaaloksiede |
metaal + suurstof → metaaloksied | nie-metaal + suurstof → nie-metaaloksied |
basies | suur |
pH > 7 | pH |
Voorbeelde: Li2O, Na2O, MgO, CaO | Voorbeelde: CO2, SO2, NO2, P2O5 |
Ons gaan in hierdie afdeling leer van die reaksies tussen metaaloksiede en sure.
Die reaksie tussen magnesiumoksied en soutsuur
Vir hierdie ondersoek word magnesiumoksied van die reaksie wanneer magnesiumlint in suurstof brand, benodig. As jy hiervan eenkant gehou het van die vroeëre aktiwiteit 'Die reaksie van magnesium met suurstof' (Chapter 3), kan leerders dit vir hierdie ondersoek gebruik. Indien nie, kan jy daardie demonstrasie maklik herhaal om nog wit magnesiumoksiedpoeier te verkry vir die volgende ondersoek. Hierdie ondersoek is ook geskik om as demonstrasie aan te bied.
Die doel van hierdie ondersoek is om:
- te toets of 'n oplossing van magnesiumoksied in water suur, basies of neutraal is; en
-
vas te stel of die reaksie tussen 'n waterige oplossing van magnesiumoksied en soutsuur 'n neutralisasiereaksie is.
ONDERSOEKENDE VRAAG(E):
Wat is die vrae wat jy hoop jy om met hierdie ondersoek te beantwoord? Skryf hulle in die spasie hier onder neer. Daar is 'n paar woorde om jou aan die gang te sit.
Wanneer die magnesiumoksied in water opgelos word, sal die resulterende oplossing suur, basies of neutraal wees?
Wanneer 'n mengsel van magnesiumoksied met soutsuur behandel word, sal die pH van die mengsel toeneem, afneem, of dieselfde bly?
OORSIG VAN DIE ONDERSOEK:
In die gebied pH > 7
Die pH sal afneem
HIPOTESE:
Wat voorspel jy? Jou hipotese moet 'n voorspelling van die bevinding(s) van die ondersoek wees. Skryf dit in die vorm van 'n moontlike antwoord op die ondersoekende vraag(e). Hier is 'n paar woorde om jou aan die gang te sit:
Wanneer magnesiumoksied in water opgelos word, sal die resulterende oplossing basies wees ('n pH > 7 hê).
Wanneer 'n oplossing van magnesiumoksied met soutsuur behandel word, sal die pH van die mengsel afneem.
MATERIALE:
- magnesiumoksiedpoeier
- water
- universele indikatorpapier (in 1-cm strokies geknip)
- wit teël of vel wit drukkerpapier
- glasstaaf (of plastiek drinkstrooitjie)
- proefbuis
- drupper
- soutsuuroplossing (HCl) (0.1 M)
Aantekeninge vir die ondersoek:
-
Leerders moet nie die soutsuur self verdun nie aangesien dit heftig met water reageer. Maak seker dat jy die suur stadig by die water voeg en NIE andersom nie.
- Om 'n 0.1 M HCl-oplossing te berei, word ongeveer 10 ml gekonsentreerde soutsuur (33% of 11 M) versigtig by 1 liter kraanwater gevoeg. Jy word aangeraai om 'n skermbril en beskermende handskoene te dra tydens hierdie stap en enige suur wat sou stort, met koue kraanwater af te spoel. Aangesien hierdie slegs 'n kwalitatiewe eksperiment is, is dit nie nodig om gedistilleerde water vir die oplossing te gebruik nie. Dit is ook nie nodig om die volumes uiters noukeurig af te meet nie.
- Die volgende riglyne sal jou help om hoeveelhede te bepaal: Die magnesiumoksied berei uit 'n 1-cm lengte magnesiumlint sal ongeveer 8 ml van 'n 0.1 M soutsuuroplossing vir volledige neutralisasie benodig. Indien die leerders in klein groepe werk en elke groep 'n klein hoeveelheid MgO (die grootte van 'n vuurhoutjiekop) in 2 ml water oplos, sal hulle slegs 'n paar druppels HCl-oplossing benodig om al die MgO te neutraliseer.
-
As jy universele indikatoroplossing het, sal dit baie mooi werk, want julle sal die kleurveranderinge kan waarneem soos die druppels bygevoeg word.
-
As jy besluit om druppers aan die leerders te gee vir die afmeet van die HCl, sal jy baie streng reëls vir die hantering van die druppers moet neerlê. Die versoeking om mekaar met water te spuit, is vir leerders moeilik om te weerstaan en hulle moet bewus gemaak word van die gevare van per ongeluk suur spuit na 'n ander leerder.
- Herinner leerders daaraan om die kleurgids vir universele indikator wat voor in die hoofstuk verskaf word, te gebruik. As jou begroting dit toelaat, sal dit 'n goeie idee wees om 'n aantal kleurfotokopieë van die kaart te maak en te laat lamineer om langer te hou.
- Herinnner die leerders om 'n tabel vir hulle resultate vooraf voor te berei.
METODE:
- Berei die universele indikatorpapier voor deur deur vyf 1-cm stukkies netjies in 'n kolom op die wit teël of vel drukkerpapier te plaas.
- Plaas 'n klein hoeveelheid (die grootte van 'n vuurhoutjiekop) van die magnesiumoksied in 'n proefbuis.
- Voeg ongeveer 2 ml kraanwater by om die meeste van die magnesiumoksied op te los.
-
Gebruik die glasstaaf (of plastiekstrooitjie) om die oplossing te roer totdat die meeste van die magnesiumoksied opgelos het. Ons gaan dit van nou af die toetsoplossing noem.
- Bring een druppel van die toetsoplossing oor op die eerste stuk universele indikatorpapier.
- Vergelyk die kleur van die papier met die kleurgids om die pH van die oplossing te vind.
- Teken hierdie pH aan in die tabel wat jy vooraf voorberei het.
- Voeg 10 druppels van die soutsuuroplossing by die toetsoplossing. Roer dit versigtig en bring nog 'n druppel van die oplossing oor op 'n vars strokie universele indikator.
- Lees die pH van die oplossing van die kleurgids af en teken dit in jou tabel aan.
- Herhaal stappe 3 en 4 totdat die pH van die toetsoplossing onder 7 val. Jy mag dalk meer as 5 stukke universele indikatorpapier benodig.
RESULTATE:
Leerder-afhanklike antwoord
-
Trek 'n grafiek van jou resultate. Hier is 'n paar wenke om jou te help besluit watter veranderlike op watter as moet kom:
Wat is jou onafhanklike veranderlike? (Watter veranderlike het jy verander?) Dit kom op die x-as.Aantal druppels HCl
Wat is jou afhanklike veranderlike? (Watter veranderlike het jy gemeet?) Dit kom op die y-as.pH
Die aantal druppels HCl behoort op die x-as van die grafiek te wees en pH op die y-as. Daar behoort 'n algemene afwaartse neiging te wees (aangesien suur by 'n basis gevoeg word, kan ons verwag dat die pH sal val), maar dit behoort nie liniêr te wees nie. Hierdie eksperiment is 'n baie elementêre 'titrasie' en 'n voorbeeld van 'n titrasiekurwe van hierdie eksperiment word hier gegee:
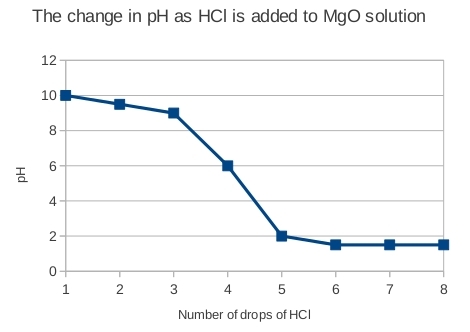
Daar word dus nie verwag dat die leerders se kurwes liniêr sal wees nie, maar dat daar eerder aanvanklik 'n geleidelike afname in pH sal wees, gevolg deur 'n vinnige val in pH wanneer al die basis geneutraliseer is. Hierna plat die kurwe weer af.
GEVOLGTREKKINGS:
Watter gevolgtrekkings kan gemaak word op grond van die resultate van jou ondersoek? Skryf jou hipotese weer oor, maar verander dit om jou bevindinge weer te gee indien hulle verskil van dit wat jy voorheen voorspel het.
Kon jy jou hipotese bevestig of verwerp?
Noudat ons 'n reaksie tussen 'n metaaloksied (MgO) en 'n suur (HCl) ondersoek het, kan ons 'n vergelyking vir die reaksie skryf. Ons sal begin deur 'n algemene vergelyking te skryf en eindig met een wat pas by die reaksie wat ons so pas ondersoek het.
'n Video wat die reaksie van koper(II)oksied met soutsuur toon
Algemene vergelyking vir die reaksie van 'n suur met 'n metaaloksied
Kan jy onthou dat jy geleer het dat 'n suur-basisreaksie 'n ruilreaksie is? Ons het geleer:
- Die suur dra H by tot die vorming van 'n watermolekule;
- Die basis dra O of OH by tot die vorming van 'n watermolekule; en
-
Wat ookal oorbly van die suur en die basis nadat 'n H2O molekule gevorm is, kom saam om 'n sout te vorm.
Die algemene woordvergelyking vir die reaksie tussen 'n suur en 'n basis is:
suur + basis → sout + water
Aangesien die basis in ons reaksie 'n metaaloksied is, kan ons skryf:
suur + metaaloksied → sout + water
Dit is die algemene woordvergelyking vir die reaksie tussen 'n suur en 'n metaaloksied. Die tipe sout wat vorm sal afhang van die spesifieke suur en metaaloksied wat in die reaksie gebruik is.
Vergelykings vir die reaksie tussen magnesiumoksied en soutsuur
Ons gaan nou leer hoe om vergelykings vir die werklike reaksie te skryf.
Die skryf van 'n chemiese vergelyking
Die volgende stappe sal jou lei:
HCl
Magnesiumoksied (MgO)
Kom ons probeer nou die produkte van die reaksie voorspel. Ons weet dat water een van die produkte sal wees.
Mg
Skryf wat oorbly van die suur (HCl) nadat ons die H weggeneem het (om water te maak). (Onthou dat ons twee H benodig om een H2O te maak).
2 Cl (ons het 2 HCl gebruik)
MgCl2
Kom ons bring dit nou alles bymekaar, eers die reaktante, dan die produkte:
2 HCl + MgO → MgCl2 + H2O
-
Kom ons maak gou seker of die reaksie gebalanseer is.
Hoeveel H-atome aan die linker- en aan die regterkant? Is hulle gebalanseer?2 H-atome links en 2 H-atome regs. Die H's is gebalanseer.
Hoeveel Cl-atome aan die linker- en aan die regterkant? Is hulle gebalanseer?2 Cl-atome links en 2 Cl-atome regs. Die Cl'e is gebalanseer.
Hoeveel O-atome aan die linker- en aan die regterkant? Is hulle gebalanseer?1 O-atoom links en 1 O-atoom regs. Die O's is gebalanseer.
Aangesien die aantal atome van elke tipe dieselfde is aan weerskante van die vergelyking, kan ons bevestig dat dit gebalanseer is.
Kom ons gebruik ten laaste die chemiese vergelyking om 'n woordvergelyking vir die reaksie te skryf:
soutsuur + magnesiumoksied → magnesiumchloried + water
Ons gaan in die volgende afdeling kyk na die reaksies tussen sure en metaalhidroksiede.
Die algemene reaksie van 'n suur met 'n metaalhidroksied
- metaalhidroksied
Ons sal hierdie afdeling begin met 'n ondersoek om die reaksie tussen 'n suur en 'n metaalhidroksied te illustreer.
Die reaksie tussen natriumhidroksied en soutsuur
Aantekeninge vir die ondersoek:
- Dieselfde voorsorg betreffende druppers en spuite is op hierdie aktiwiteit van toepassing. Jy sal baie streng reëls vir die hantering van hierdie items moet neerlê sodat leerders nie in die versoeking kom om mekaar met water te spuit nie.
- Onthou om 'n kleurgids vir universele indikator aan die leerders te verskaf indien jy dit het.
- Herinner die leerders daaraan om 'n resultaattabel te teken voordat hulle met die eksperiment begin.
Die doel van hierdie ondersoek is om:
- te toets of natriumhidroksied suur of basies is; en
- vas te stel of die reaksie tussen natriumhidroksied en soutsuur 'n neutralisasiereaksie is.
ONDERSOEKENDE VRAAG(E):
Hier is 'n paar idees:
- Wanneer natriumhidroksied in water opgelos word, sal die resulterende oplossing suur, basies of neutraal wees?
- Wanneer 'n oplossing van natriumhidroksied met soutsuur behandel word, sal die pH van die mengel toeneem, afneem of dieselfde bly?
- Sal dit moontlik wees om al die natriumhidroksied te neutraliseer deur soutsuur by te voeg?
OORSIG VAN DIE ONDERSOEK:
In die gebied pH > 7
Die pH sal afneem
HIPOTESE:
'n Paar idees:
- Natriumhidroksiedoplossing se pH sal hoër as 7 wees.
- Wanneer 'n oplossing van natriumhidroksied met soutsuur behandel word, sal die pH van die mengsel afneem.
- Deur soutsuur by die natriumhidroksiedoplossing te voeg, behoort dit moontlik te wees om die pH af te bring na 7 en selfs onder 7.
MATERIALE:
- natriumhidroksiedoplossing (0.1 M)
Berei 'n 0.1 M NaOH-oplossing deur ongeveer 4 g NaOH-korrels in 1 liter koue kraanwater op te los. Dra 'n skermbril en handskoene aangesien daar 'n moontlikheid is dat die natriumhidroksiedoplossing kan spat.
- universele indikatorpapier (in 1-cm strokies geknip)
- wit teël of vel wit drukkerpapier
- glasstaaf of plastiek drinkstrooitjie
- proefbuis of klein glasbeker
- plastiekspuit (2.5 ml inhoudsmaat)
- soutsuuroplossing (HCl) (0.1 M)
Instruksies vir bereiding word met die vorige ondersoek gegee: Die reaksie tussen magnesiumoksied en soutsuur
METODE:
- Berei die universele indikatorpapier voor deur deur vyf 1-cm stukkies netjies in 'n kolom op die wit teël of vel drukkerpapier te plaas.
-
Gebruik die spuit om 2 ml van die natriumhidroksiedoplossing in die proefbuis of klein glasbeker oor te bring. Ons gaan dit voortaan die toetsoplossing noem.
- Spoel die spuit baie deeglik met water uit en droog dit met skoon sneespapier uit. Vul dit nou met soutsuuroplossing en sit dit eenkant.
- Bring een druppel van die natriumhidroksied (toetsoplossing) oor op die eerste stukkie universele indikatorpapier.
- Vergelyk die kleur van die papier met die kleurgids om die pH van die natriumhidroksiedoplossing te vind. Teken hierdie pH aan in jou resultaattabel.
- Voeg 0.5 ml van die soutsuuroplossing van die spuit by die toetsoplossing. Roer dit versigtig met die glasstaaf of strooitjie en bring nog 'n druppel van die toetsoplossing op 'n vars strokie universele indikatorpapier oor.
- Lees die pH van die oplossing van die kleurgids af en noteer dit in jou resultaattabel.
Leerder-afhanklike antwoord. Behoort ongeveer 2 ml te wees.
- As jy heeltemal seker is dat al die basis deur die suur geneutraliseer is (die pH behoort 7 te wees en die universele indikatorpapier moes na groen verander het), kan jy die toetsoplossing in 'n klein glasbeker gooi en vir 'n paar dae op die vensterbank laat. Onthou om later terug te kom om te kom kyk wat daarvan geword het.
NaCl vorm in hierdie reaksie en die idee is dat die leerders dit op die vensterbank moet laat uitdroog en later ondersoek. Dit is waarskynlik nie 'n goeie idee om hulle daaraan te laat proe nie, aangesien al die suur of basis moontlik nie geneutraliseer is nie.
RESULTATE:
leerder-afhanklike antwoord
-
Trek 'n grafiek van jou resultate.
Wat is jou onafhanklike veranderlike? (Watter veranderlike het jy verander?)Volume HCl
Wat is jou afhanklike veranderlike? (Watter veranderlike het jy gemeet?)pH
Die volume HCl bygevoeg moet op die x-as van die grafiek wees en pH op die y-as. Daar behoort 'n algemene neiging afwaarts te wees (aangesien suur by 'n basis gevoeg word, kan ons verwag dat die pH sal val), maar dit moet nie liniêr wees nie. Kyk na die opmerkings en grafiek wat met die vorige ondersoek verskaf is.
GEVOLGTREKKINGS:
Watter gevolgtrekkings kan van die resultate van jou ondersoek gemaak word? Jy kan jou hipotese hier oorskryf, maar dit verander om jou bevindinge weer te gee indien hulle verskil van dit wat jy vroeër voorspel het.
Kon jy jou hipotese bevestig of verwerp?
Noudat ons 'n reaksie tussen 'n metaalhidroksied (NaOH) en 'n suur (HCl) ondersoek het, kan ons 'n vergelyking vir die reaksie skryf. Ons sal begin deur 'n algemene reaksie te skryf en eindig met een wat pas by die reaksie wat ons so pas ondersoek het.
'n Video wat die reaksie van magnesiumhidroksied met soutsuur in die teenwoordigheid van universele indikator illustreer
Algemene vergelyking vir die reaksie van 'n suur met 'n metaalhidroksied
Jy het geleer dat 'n suur-basisreaksie deur die volgende algemene woordvergelyking voorgestel kan word:
suur + basis → sout + water
Die basis in ons reaksie was 'n metaalhidroksied, dus word die algemene vergelyking:
suur + metaalhidroksied → sout + water
Hierdie is die algemene vergelyking vir die reaksie tussen 'n suur en 'n metaalhidroksied. Die tipe sout wat vorm sal afhang van die spesifieke suur en metaalhidroksied wat in die reaksie gebruik is.
Vergelykings vir die reaksie tussen natriumhidroksied en soutsuur
Ons gaan nou leer hoe om vergelykings vir die werklike reaksie te skryf.
Die skryf van 'n chemiese vergelyking
Die volgende stappe sal jou lei:
HCl
Natriumhidroksied (NaOH)
Kom ons probeer nou die produkte van die reaksie voorspel. Ons weet dat water een van die produkte sal wees.
Na
Skryf wat van die suur oorbly nadat ons die H weggeneem het om water te maak. Onthou dat ons twee H benodig om een H2O te maak, maar NaOH het reeds een O en een H bygedra. Sit nou die twee fragmente bymekaar. Plaas die metaal van die basis eerste en die nie-metaal van die suur laaste. Een Na en een Cl vorm...
NaCl
Kom ons bring dit nou alles bymekaar, in die volgende volgorde: Suur + metaalhidroksied → sout + water
HCl + NaOH → NaCl + H2O
Kom ons maak gou seker of die reaksie gebalanseer is.
- Hoeveel H-atome aan die linkerkant en aan die regterkant? Is hulle gebalanseer?
- Hoeveel Cl-atome aan die linker- en regterkant? Is hulle gebalanseer?
- Hoeveel O-atome aan die linker- en regterkant? Is hulle gebalanseer?
-
2 H-atome aan die linkerkant and 2-H atome aan die regterkant. Die H's is gebalanseer.
-
1 Cl-atoom links en 1 Cl-atoom regs. Die Cl'e is gebalanseer.
-
1 O-atoom links en 1 O-atoom regs. Die O's is gebalanseer.
Nadat jy hierdie reaksie uitgevoer het en 'n neutrale oplossing oorhet, besluit jy om die natriumchloried (tafelsout) te herwin. Hoe sal jy dit doen?
Jy moet die water laat verdamp sodat die sout uitkristalliseer, deur dit op 'n sonnige plek te laat of deur die oplossing te kook.
Kom ons gebruik ten laaste die chemiese vergelyking om 'n woordvergelyking vir die reaksie te skryf:
soutsuur + natriumhidroksied → natriumchloried + water
Ons gaan in die volgende afdeling kyk na die reaksies tussen sure en metaalkarbonate.
Die algemene reaksie van 'n suur met 'n metaalkarbonaat
- metaalkarbonaat
Ons gaan in hierdie afdeling die reaksie tussen 'n suur en 'n metaalkarbonaat ondersoek.

Die reaksie tussen kalsiumkarbonaat (bordkryt) en soutsuur
Maal 'n paar stukke wit bordkryt vir hierdie eksperiment fyn. Die kalsiumkarbonaat sal nie eintlik goed in water oplos nie, maar dit behoort moontlik te wees om met die klein hoeveelheid kalsiumkarbonaat wat wel oplos wanneer die bordkrytpoeier in water gesuspendeer word, te bepaal dat die oplossing basies is.
Leerders sal hul kleurkaarte en resultaattabelle benodig voordat hulle begin.
Die doel van hierdie ondersoek is om:
- te toets of kalsiumkarbonaat suur of basies is;
- te bepaal of die reaksie tussen kalsiumkarbonaat en soutsuur 'n neutralisasiereaksie is; en
- die produkte van die reaksie tussen kalsiumkarbonaat en soutsuur te bepaal.
ONDERSOEKENDE VRAE:
'n Paar idees:
- Wanneer kalsiumkarbonaat in water opgelos word, sal die resulterende oplossing suur, basies of neutraal wees?
- Wanneer 'n oplossing van kalsiumkarbonaat met soutsuur behandel word, sal die pH van die mengsel toeneem, afneem of dieselfde bly?
- Sal dit moontlik wees om al die kalsiumkarbonaat te neutraliseer deur soutsuur by te voeg? (Oppas dat jy nie wanbegrippe hier inbring nie)
- Watter ander produkte sal vorm wanneer kalsiumkarbonaat met soutsuur reageer?
OORSIG VAN DIE ONDERSOEK:
Ons sal die pH van 'n suspensie van kalsiumkarbonaat (CaCO3) met universele indikatorpapier meet om te bevestig of dit suur of basies is. In watter gebied verwag jy sal die pH van die kalsiumkarbonaat val?
In die gebied pH > 7
Die pH sal afneem
HIPOTESE:
'n Paar idees:
- Kalsiumkarbonaatoplossing se pH sal hoër as 7 wees
- Wanneer kalsiumkarbonaat met soutsuur behandel word, sal die pH van die mengsel afneem
- Deur soutsuur by die kalsiumkarbonaat te voeg, behoort dit die pH af te bring na 7 en selfs onder 7
MATERIALE:
- bordkrytstof (kalsiumkarbonaat) in 'n klein hoeveelheid water gesuspendeer.
- universele indikatorpapier (in 1-cm strokies geknip)
- wit teël of vel wit drukkerpapier
- glasstaaf of plastiek drinkstrooitjie
- proefbuis of klein glasbeker
- plastiekspuit (2.5 ml inhoudsmaat) of drupper
- soutsuuroplossing (HCl) (0.1 M)
METODE:
- Berei die universele indikatorpapier voor deur deur vyf 1-cm stukkies netjies in 'n kolom op die wit teël of vel drukkerpapier te plaas.
-
Plaas ongeveer 2 ml van die kalsiumkarbonaatsuspensie in 'n proefbuis of klein glasbeker. Ons sal dit van nou af die toetsoplossing noem.
- Spoel die spuit baie deeglik met water uit en droog dit met skoon sneespapier uit. Vul dit nou met soutsuuroplossing en sit dit eenkant.
- Bring een druppel van die kalsiumkarbonaat (toetsoplossing) na die eerste stukkie universele indikatorpapier oor.
- Vergelyk die kleur van die papier met die kleurgids hier onder om die pH van die kalsiumkarbonaatoplossing te vind. Teken hierdie pH aan in jou resultaattabel.
- Voeg 0.5 ml van die soutsuuroplossing van die spuit by die toetsoplossing. Let baie mooi op wat gebeur. Sien jy enigiets interessants? (Wenk: Kyk uit vir borrels!) Roer die toetsoplossing versigtig met die glasstaaf en bring nog 'n druppel daarvan oor op 'n vars strokie universele indikator.
- Lees die pH van die oplossing van die kleurgids af en teken dit in jou tabel aan.
- Herhaal stappe 6 en 7 totdat die pH van die toetsoplossing ongeveer 7 bereik. Hoeveel van die soutsuuroplossing het jy gebruik? Skryf die volume in die spasie hier onder neer.
- Jou onderwyser sal die eksperiment as 'n demonstrasie herhaal en die gas opvang wat gedurende die reaksie gevorm het, vir toetsing met helder kalkwater.
Voer die eksperiment in 'n koniese fles as volg uit:
-
2 in 'n ander koniese fles wat kalkwater bevat (sien diagram hieronder). Die CO2 gas moet uitegooi word. Skud die koniese fles wat die kalkwater en CO2 bevat om menging aan te help. Laat die leerders toe om hulle observasies te maak. 2 is digter as lug en sal vir 'n paar minute in die fles bly voor dit diffendeer. Gedurende hierdie tyd moet dit oor die kalkwater gegooi word. Moenie dat enige van die toetsoplossing in die kalkwater beland nie, net die CO
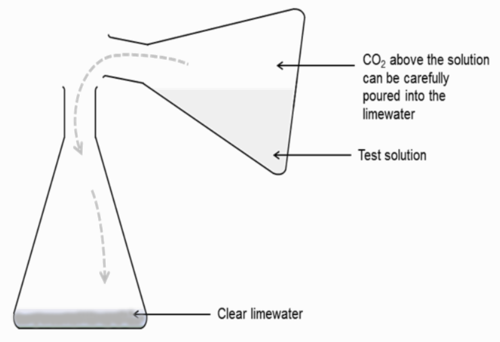
As alternatief kan jy 'n opstelling soos die een in die onderstaande diagram gebruik:
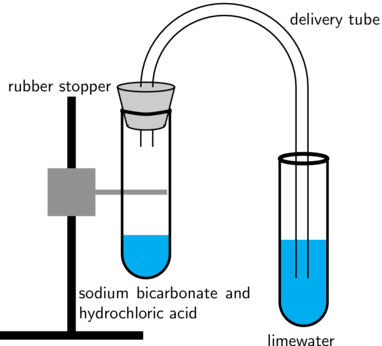
Hierdie eksperiment kan ook met 'n magnetiese roerder gedoen word.
Koolstofdioksied, CO2
RESULTATE:
- Toon jou resultate in 'n netjiese tabel. Gebruik gepaste opskrifte vir jou tabel. 'Volume HCl bygevoeg' en 'Kleur van die universele indikatorpapier' en 'pH van die toetsoplossing' is voorgestelde opskrifte vir jou kolomme.
-
Trek 'n grafiek van jou resultate.
Wat is jou onafhanklike veranderlike? (Watter veranderlike het jy verander?)Volume HCl
Wat is jou afhanklike veranderlike? (Watter veranderlike het jy gemeet?)pH
GEVOLGTREKKINGS:
Watter gevolgtrekkings kan van die resultate van jou ondersoek gemaak word? Jy kan jou hipotese hier oorskryf, maar dit verander om jou bevindinge weer te gee indien hulle verskil van dit wat jy vroeër voorspel het.
Kon jy jou hipotese bevestig of verwerp?
Noudat ons 'n reaksie tussen 'n metaalkarbonaat (CaCO3) en 'n suur (HCl) ondersoek het, kan ons 'n vergelyking vir die reaksie skryf. Ons sal begin deur 'n algemene vergelyking te skryf en eindig met een wat pas by die reaksie wat ons so pas ondersoek het.
'n Video wat die reaksie tussen metaalkarbonate en sure toon
Algemene vergelyking vir die reaksie van 'n suur met 'n metaalkarbonaat
Die algemene vergelyking vir die reaksie tussen 'n suur en 'n basis is as volg:
suur + basis → sout + water
As ons basis met metaalkarbonaat vervang, kry ons:
suur + metaalkarbonaat → sout + water
Maar wag, daar was 'n derde produk in ons reaksie! Kan jy onthou wat dit was? (Wenk: Borrels het gevorm, dus was dit 'n gas.)
CO2
Ons moet dit duidelik stel dat CO2 'n produk van die reaksie was, en dus sal die korrekte algemene woordvergelyking wees:
suur + metaalkarbonaat → sout + water + koolstofdioksied
Die tipe sout wat vorm sal afhang van die spesifieke suur en metaalkarbonaat wat in die reaksie gebruik is.
Vergelykings vir die reaksie tussen kalsiumkarbonaat en soutsuur
Ons gaan nou leer hoe om vergelykings vir die werklike reaksie te skryf.
Die skryf van 'n chemiese vergelyking
Die volgende stappe sal jou lei:
HCl
Kalsiumkarbonaat (CaCO3)
Skryf wat van die basis oorbly nadat ons die CO3 weggeneem het om CO2 te maak en een O laat om water te vorm.
Ca
Skryf wat oorbly van die suur nadat ons die H weggeneem het om water te maak. Onthou dat ons twee H benodig om een H2O te maak en CaCO3 het net een O bygedra.
2 HCl word benodig, dus 2 Cl sal oorbly.
CaCl2
Kom ons bring dit nou alles bymekaar, eers die reaktante, dan die produkte:
2 HCl + CaCO3→ CaCl2 + H2O + CO2
-
Kom ons maak gou seker of die reaksie gebalanseer is.
Hoeveel H aan die linker- en regterkant? Is hulle gebalanseer?2 H links en 2 H regs. Die H's is gebalanseer.
Hoeveel Cl links en regs? Is hulle gebalanseer?2 Cl links en 2 Cl regs. Die Cl'e is gebalanseer.
Hoeveel O aan die linker- en regterkant? Is hulle gebalanseer?3 O links en 3 O regs. Die O's is gebalanseer.
Hoeveel C links en regs? Is hulle gebalanseer?1 C links en 1 C regs. Die C's is gebalanseer.
Kom ons gebruik ten laaste die chemiese vergelyking om 'n woordvergelyking vir die reaksie te skryf:
soutsuur + kalsiumkarbonaat → kalsiumchloried + water + koolstofdioksied
Toepassings van kalsiumkarbonaat
Kalsiumkarbonaat word op vele plekke buite die laboratorium gevind. Dit word oral in die wêreld in verskillende tipes rots, soos byvoorbeeld kalksteen, krytklip en marmer gevind.

Kalsiumkarbonaat is ook die hoofbestanddeel van die skulpe van verskeie see-organismes, slakke, pêrels, oesters en voëleierdoppe. Dit word ook gevind in die eksoskelette van skaaldiere (soos krappe, garnale en krewe).

Donkergroen blaargroente soos broccoli, boerkool en kopkool is 'n voedselbron van kalsiumkarbonaat wat die liggaam van kalsium voorsien. Jy kan ook kalsiumkarbonaat in die vorm van tabletaanvullings neem.
Kalsiumkarbonaat het ook baie toepassings. In die industrie is die belangrikste aanwending in konstruksie waar dit in verskeie boumateriale en in sement gebruik word. Kalsiumkarbonaat word in baie kleefstowwe, verwe en in keramiekware gebruik. Dit word in swembaddens gebruik om die pH te verander. Wanneer dink jy sal dit bygevoeg word? As die swembad té suur is en jy dit meer basies wil maak, of as dit té basies is en jy dit meer suur wil maak?
CaCO3 vorm 'n basiese oplossing in water en dit word dus gebruik as die pH té laag is (té suur) en jy die swembadwater meer basies wil maak.
Kalsiumkarbonaat word ook in die landbou in die vorm van kalkpoeier gebruik. Landbou kalk word gemaak deur kalksteen of kryt fyn te maal. Dit word by die grond gevoeg om die pH te verhoog as die grond té suur is. Dit voorsien ook 'n bron van kalsium aan plante.

Ons het in hierdie hoofstuk 'n aantal reaksies van sure en basisse ondersoek. Ons het geleer om woordvergelykings vir hierdie reaksies te skryf asook gebalanseerde chemiese vergelykings, en geoefen om tussen die twee skryfwyses te skakel.
Opsomming
- Die reaksie van 'n suur met 'n basis word 'n neutralisasiereaksie genoem.
- Wanneer 'n suur (pH 7) gevoeg word, sal die pH van die resulterende mengsel iewers tussen dié van die suur en dié van die basis lê. Alhoewel die suur en basis geneutraliseer sal wees, sal die resulterende oplossing nie noodwendig neutraal wees nie.
-
Algemene laboratoriumsure sluit swaelsuur (H2SO4), salpetersuur (HNO3) en soutsuur (HCl) in.
- Nie-metaaloksiede is geneig om suuroplossings te vorm wanneer hulle in water oplos. Hierdie oplossings sal pH-waardes onder 7 hê.
- Metaaloksiede, metaalhidroksiede en metaalkarbonate vorm basiese oplossings in water; hierdie oplossings sal pH-waardes bokant 7 hê.
- Wanneer 'n metaaloksied of 'n metaalhidroksied met 'n suur reageer, vorm 'n sout en water as produkte.
- Wanneer 'n metaalkarbonaat met 'n suur reageer, vorm 'n sout, water en koolstofdioksied as produkte.
- Die algemene woordvergelykings vir die reaksies van hierdie hoofstuk is die volgende:
-
suur + metaaloksied → sout + water
-
suur + metaalhidroksied → sout + water
-
suur + metaalkarbonaat → sout + water + koolstofdioksied
-
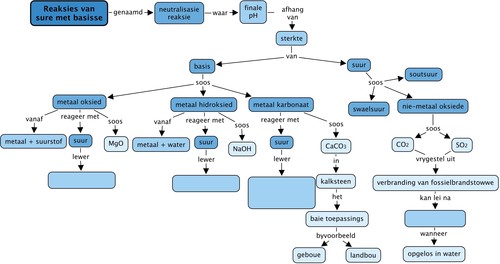
Konsepkaart
Voltooi die konsepkaart deur die oop spasies in te vul.
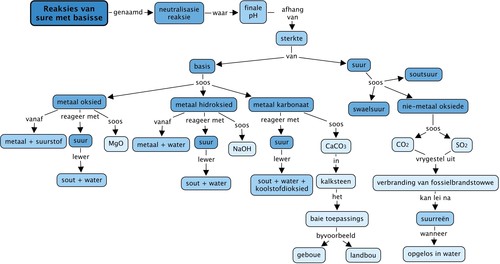
Dit is die voltooide konsepkaart.
Hersieningsvrae
-
Vul die ontbrekende woorde in hierdie sinne in. Skryf die woord op die lyn hier onder. [10 punte]
Om vas te stel of iets 'n suur of 'n basis is, meet ons sy _______.
pH
Die naam van die laboratoriumsuur met die formule H2SO4, is _______.
swawelsuur
Die formule vir die laboratoriumsuur bekend as soutsuur, is _______.
HCl
Wanneer 'n metaaloksied met 'n ______ reageer, sal 'n sout en water gevorm word.
suur
Wanneer 'n metaalhidroksied met 'n suur reageer, sal 'n sout en _____ gevorm word.
water
Wanneer 'n metaalkarbonaat met 'n suur reageer, sal 'n sout, water en _______ gevorm word.
koolstofdioksied
Metaaloksiede, metaalhidroksiede en metaalkarbonate los almal in water op om ______ oplossings te vorm. Dit beteken die oplossings sal pH-waardes ____ as 7 hê.
basiese; hoër
Die reaksie van 'n suur met 'n basis word 'n _______ reaksie genoem.
neutralisasie
Nie-metaaloksiede neig om ______ oplossings te vorm wanneer hulle in water oplos.
suur
-
Skryf 'n kort paragraaf (3 of meer sinne) om in jou eie woorde te verduidelik wat jy onder elkeen van die volgende terme verstaan. [2 x 3 = 6 punte]
neutralisasieLeerder se paragraaf behoort ten minste die volgende idees te bevat:
- Wanneer 'n suur en 'n basis gemeng word, sal die suur 'n mate van 'suurheid' verloor en die basis 'n mate van 'basisiteit' verloor.
-
Indien hulle in die regte hoeveelhede gemeng word, neutraliseerhulle mekaar.
- Die produkte van die reaksie sal 'n sout en water wees.
suurreënLeerder se paragraaf behoort ten minste die volgende idees te bevat:
- Sekere industrieë (en selfs sommige natuurlike verskynsels soos vulkaniese uitbarstings) produseer nie-metaaloksiede as afvalprodukte.
- Nie-metaaloksiede vorm suuroplossings wanneer hulle in atmosferiese waterdruppeltjies oplos.
- Hierdie suuroplossings reën op die Aarde se oppervlak neer en kan skade aanrig aan geboue en plantlewe en waterbronne suur maak.
-
Voltooi die tabelle deur die ontbrekende vergelykings te verskaf vir elk van die volgende reaksies.
Die reaksie tussen soutsuur en magnesiumoksied [4 punte]
Woordvergelyking
Chemiese vergelyking
Algemene vergelyking
suur + metaaloksied → sout + water
Woordvergelyking
soutsuur + magnesiumoksied → magnesiumchloried + water
Chemiese vergelyking
2 HCl + MgO → MgCl2 + H2O
Algemene vergelyking
suur + metaaloksied → sout + water
Die reaksie tussen soutsuur en natriumhidroksied [6 punte]
Woordvergelyking
Chemiese vergelyking
Algemene vergelyking
Woordvergelyking
soutsuur + natriumhidroksied → natriumchloried + water
Chemiese vergelyking
HCl + NaOH → NaCl + H2O
Algemene vergelyking
suur + metaalhidroksied → sout + water
Die reaksie tussen soutsuur en kalsiumkarbonaat [4 punte]
Woordvergelyking
Chemiese vergelyking
2 HCl + CaCO3 → CaCl2 + H2O + CO2
Algemene vergelyking
Woordvergelyking
soutsuur + kalsiumkarbonaat → kalsiumchloried + water + koolstofdioksied
Chemiese vergelyking
2 HCl + CaCO3 → CaCl2 + H2O + CO2
Algemene vergelyking
suur + metaalkarbonaat → sout + water + koolstofdioksied
Die reaksie tussen soutsuur en magnesiumhidroksied [4 punte]
Woordvergelyking
Chemiese vergelyking
2 HCl + Mg(OH)2 → MgCl2 + 2 H2O
Algemene vergelyking
Woordvergelyking
soutsuur + magnesiumhidroksied → magnesiumchloried + water
Chemiese vergelyking
2 HCl + Mg(OH)2 → MgCl2 + 2 H2O
Algemene vergelyking
suur + metaalhidroksied → sout + water
Die reaksie tussen soutsuur en kalsiumoksied [4 punte]
Woordvergelyking
Chemiese vergelyking
2 HCl + CaO → CaCl2 + H2O
Algemene vergelyking
Woordvergelyking
soutsuur + kalsiumoksied → kalsiumchloried + water
Chemiese vergelyking
2 HCl + CaO → CaCl2 + H2O
Algemene vergelyking
suur + metaaloksied → sout + water
Die reaksie tussen soutsuur en kaliumhidroksied [6 punte]
Woordvergelyking
Chemiese vergelyking
Algemene vergelyking
Woordvergelyking
soutsuur + kaliumhidroksied → kaliumchloried + water
Chemiese vergelyking
HCl + KOH → KCl + H2O
Algemene vergelyking
suur + metaalhidroksied → sout + water
Die reaksie tussen soutsuur en natriumkarbonaat [4 punte]Woordvergelyking
soutsuur + natriumkarbonaat → natriumchloried + water + koolstofdioksied
Chemiese vergelyking
Algemene vergelyking
Woordvergelyking
soutsuur + natriumkarbonaat → natriumchloried + water + koolstofdioksied
Chemiese vergelyking
2 HCl + Na2CO3 → 2 NaCl + H2O + CO2
Algemene vergelyking
suur + metaalkarbonaat → sout + water + koolstofdioksied
Totaal [48 punte]



