Die proses word smelting genoem.
Deeltjiemodel van materie
Hoofstuk oorsig
5 weke
Hierdie hoofstuk bou voort op die inleiding tot die rangskikking van partikels in materiale wat in die hoofstuk 'Vaste stowwe, Vloeistowwe en Gasse' van die Gr. 6 Materie en Materiale leerplan behandel is. In Gr. 6 is geen onderskeid tussen atome en molekules gemaak nie. Hulle is saamgegroepeer en die generiese term 'partikel' is gebruik om na hierdie fundamentele boublokke van materie te verwys. Dit was die eerste bekendstelling aan die konsep van materiedeeltjies. Die gedrag van partikels in elk van die drie verskillende toestande van materie is gebruik om die makroskopiese eienskappe van elke toestand te verduidelik. Hierdie begrippe word in hierdie hoofstuk verder uitgebrei, deur middel van die deeltjiemodel van materie. Belangrike skakeling word gemaak na nuwe konsepte soos diffusie, toestandveranderings, digtheid, uitsetting, inkrimping en gasdruk. Die deeltjiemodel van materie sal 'n sterk tema dwarsdeur die res van die Fisiese Wetenskappe kurrikulum wees, veral as leerders na Gr. 10-12 aangaan.
2.1: Wat is die deeltjiemodel van materie? (1 uur)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Hersiening van toestandveranderings | Verkryging en weergee van inligting, hersiening | Voorgestel (hersiening) |
2.2 Vaste stowwe, vloeistowwe en gasse (3 ure)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Vergelyking van vaste stowwe, vloeistowwe en gasse | Verkryging en weergee van inligting, vergelyking | KABV voorgestel |
Ondersoek: Vergelyking van die diffusie van partikels in 'n gas en in 'n vloeistof | Stel van hipotese, waarneming, identifisering van veranderlikes, aanteken van inligting, vergelyking, interpretering van inligting | KABV voorgestel |
2.3 Verandering van toestand (2 ure)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Toestandveranderings | Kort vrae, lees en skryf, sortering en klassifisering | Opsionele hersiening |
Ondersoek: Wat gebeur as ons kerswas verhit en daarna afkoel? | Voorspelling, stel van hipotese, beplanning van ondersoek, teken en etikettering, waarneming, notering, analisering van inligting | KABV voorgestel |
Aktiwiteit: Warmlugballon | Waarneming, notering van inligting | Opsionele uitbreiding |
2.4 Digtheid, massa en volume (1 uur)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Watter materiaal is die digste? | Uitvoering van 'n ondersoek, waarneming, vergelyking, kommunikasie en groepbespreking | KABV voorgestel |
2.5 Digtheid en toestande van materie (1 uur)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Watter een is die digste: 'n vaste stof, 'n vloeistof of 'n gas? | Vergelyking, interpretering | Voorgestelde |
2.6 Digtheid van verskillende materiale (3 ure)
Take | Vaardighede | Aanbeveling |
Ondersoek: Vergelyking van die digthede van sand, meel, water en lug | Stel van hipotese, identifisering van veranderlikes, beplanning van 'n ondersoek, uitvoering van 'n ondersoek, waarneming, notering van inligting, interpretering van inligting | KABV voorgestel |
Aktiwiteit: Reënboog digtheidskolom | Demonstrasie van digthede, vergelyking, waarneming, teken, vergelyking | Voorgestelde |
Aktiwiteit: 'n Paar berekeninge van digtheid | Probleem-oplossing, berekeninge | Opsionele uitbreiding |
2.7 Uitsetting en inkrimping van materiale (2 ure)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Hoeveel langer? | Teken van grafieke, interpretering van inligting, demonstrasie | KABV voorgestel |
Aktiwiteit: Hoe werk 'n termometer? | Hersiening, vergelyking, identifisering | Voorgestelde |
2.8 Druk (2 ure)
Take | Vaardighede | Aanbeveling |
Aktiwiteit: Die verstaan van gasdruk | Uitvoering van instruksies, waarneming, interpretering van inligting | KABV voorgestel |
- Wat is die deeltjiemodel van materie?
- Hoe klein is atome en molekules?
- Hoe beskryf die deeltjiemodel van materie vaste stowwe, vloeistowwe en gasse?
- Hoe help die deeltjiemodel van materie ons om die proses van diffusie te verstaan?
- Hoe kan ons materiale van toestand laat verander?
- Hoe help die deeltjiemodel van materie ons om veranderinge in die toestand van materiale, soos smelting, verdamping, kondensasie en vriesing, te verstaan?
- Wat is die verband tussen digtheid, massa en volume?
- Hoe vergelyk die digthede van vaste stowwe, vloeistowwe en gasse?
- Watter aspekte van die partikels in 'n gegewe materiaal beïnvloed die digtheid van daardie materiaal?
- Waarom dryf olie op water? Hou dit verband met digtheid?
- Hoe kan die deeltjiemodel van materie ons help om uitsetting en inkrimping te verstaan?
- Hoe oefen 'n gas druk uit?
- Is die druk wat 'n gas uitoefen verwant aan die aantal gaspartikels? Indien wel, hoe?
- Wat gebeur met druk wanneer ons sy volume en temperatuur verander?
Onthou jy dat jy geleer het dat materie in drie verskillende toestande kan voorkom? Wat word die drie toestande genoem?
Vaste stowwe, vloeistowwe en gasse
Kan jy die eienskappe van die verskillende toestande van materie onthou? Bespreek dit in die klas. Kyk na die volgende diagram van die toestande van materie om jou te help. Onthou om 'n paar aantekeninge te maak tydens julle bespreking in die klas.
Moedig leerders aan om dit kortliks in groepies te bespreek en teken 'n tabel op die bord om leerders se idees op te som. Drie groepe kan lukraak uit die klas gekies word wat elk kan sê wat hulle van een van die toestande weet. Sommige van die eienskappe waarmee leerders reeds vertroud behoort te wees, word in die volgende tabel aangegee:
Gasse | Vloeistowwe | Vaste stowwe |
|
|
|

Ons gaan in hierdie hoofstuk hersien wat ons weet van vaste stowwe, vloeistowwe en gasse. Ons gaan leer van 'n wetenskaplike model wat gebruik kan word om die gedrag van partikels in al drie toestande te beskryf. Hierdie model word die deeltjiemodel van materie genoem en dit gaan ons help om baie meer te verstaan van die eienskappe van vaste stowwe, vloeistowwe en gasse. Kom ons begin!
Wat is die deeltjiemodel van materie?
- wetenskaplike teorie
- verskynsel
- ongeorden
- uniform
- willekeurig
- omgekeerde
- gekontroleerde eksperiment
Ons het in die vorige hoofstuk geleer dat wetenskaplikes modelle gebruik wanneer hulle goed wil beskryf wat moeilik is om te verstaan. Ons het 'n model van die atoom bespreek wat ons gehelp het om vir ons voor te stel hoe atome lyk.
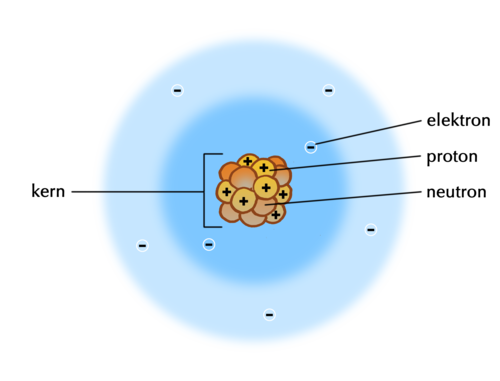
Teorieë is soortgelyk aan modelle. Hulle verduidelik wetenskaplike verskynsels (dinge en gebeure wat in wetenskaplike terme beskryf en verduidelik kan word) deur beelde en woorde te gebruik.
Wat leer die deeltjiemodel van materie vir ons?
Die deeltjiemodel beskryf materie op 'n baie spesifieke manier. Dit beskryf vier belangrike aspekte van materie:
- Alle materie is saamgestel uit partikels wat ongelooflik klein is - veels te klein om met die blote oog te sien. Die partikels kan atome of groepe atome wees wat saamgebind is.
- Daar is kragte tussen die partikels.
- Die partikels in materie is gedurig aan die beweeg. Hoe meer energie hulle besit, hoe vinniger beweeg hulle.
Dit hou verband met Gr. 6 Energie en Verandering waar die onderwerpe van gebergde energie en bewegingsenergie behandel is. In Kwartaal 3, Energie en Verandering, sal hierdie konsepte meer formeel as kinetiese energie (bewegingsenergie) en potensiële energie (gebergde energie) gedefinieer word.
- Die spasies tussen die partikels in materie is leeg. Jy mag dalk aanneem dat die spasies tussen partikels met lug gevul is, maar dit is nie die geval nie. Hulle bevat heeltemal niks nie.
Dit is baie belangrik om hier op te let na die wanbegrip dat daar 'lug' tussen die partikels is. Dit is NIE waar nie. Die spasies tussen die partikels is leeg - dit word 'n vakuum genoem. Maak seker dat jy nie hierdie wanbegrip inbring nie.
Indien nodig, kan jy teruggaan na hoofstuk 1 om die terme atoom, element, verbinding en molekule, en hul verwantskap, te hersien.
Waarom is die deeltjiemodel van materie so nuttig?
Die deeltjiemodel van materie is een van die nuttigste wetenskaplike modelle, want dit beskryf materie in al drie toestande. Dit is noodsaaklik om die gedrag van die partikels van materie te verstaan as ons hoop om wetenskap te verstaan!
Die model help ons ook om te verstaan wat met die partikels gebeur wanneer materie verander van een toestand na 'n ander.
Die volgende diagram toon verskillende toestandveranderings, asook watter prosesse die omgekeerde van mekaar is. Smelting en vriesing is die omgekeerde prosesse van mekaar en so ook verdamping (kook) en kondensasie.
Onder spesiale omstandighede kan 'n vaste stof direk na 'n gas verander sonder om eers te smelt. Hierdie proses staan bekend as sublimasie en sy omgekeerde (wanneer 'n gas direk na 'n vaste stof verander sonder om eers te kondenseer) word dampneerslag genoem.
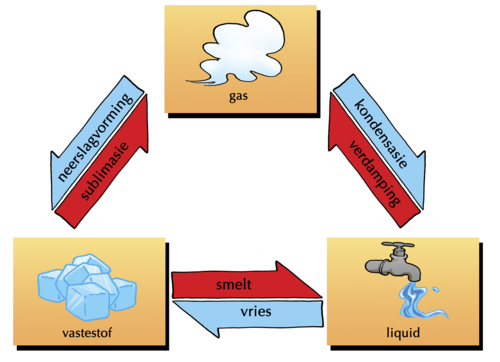
Hersiening van toestandverandering
INSTRUKSIES:
- Verwys na die vorige diagram.
- Kontroleer dat jy die konsepte waarvan jy in vorige grade geleer het, onthou deur hierdie vinnige vrae te beantwoord.
VRAE:
Vriesing.
Ons kan dit op 'n warm plek sit, of op 'n ander manier verhit.
Dit moet eers smelt om 'n vloeistof te word en dan verdamp om 'n gas te word.
Kondensasie.
Verhitting is toevoeging van energie.
Hulle vibreer of beweeg vinniger.
Dit is omdat hulle nou meer kinetiese energie het. Dit lei die volgende onderwerp in en hoe ons toestandverandering aan die hand van die deeltjiemodel verduidelik.
Ons sal die model gebruik om elkeen van hierdie veranderinge van nader te beskou. Maar eerstens gaan ons kyk na hoe die model elke toestand van materie beskryf.
Vaste stowwe, vloeistowwe en gasse
- saampers
- bots
- diffundeer
- tempo
- konstante beweging
- waarneming
- aantrekkingskragte
- reëlmatige rangskikking
- vibreer
Ons kan die deeltjiemodel gebruik om ons te help om die gedrag van elk van die toestande van materie te verstaan. Ons gaan na elke toestand op sy beurt kyk.
Daar is een baie belangrike aspek om in gedagte te hou wanneer ons na die verskillende toestande van materie kyk. Vir enige materie is die individuele partikels van daardie materie presies dieselfde in al drie toestande, vaste stof, vloeistof en gas. Dit is die gedrag van die partikels wat in elke toestand verander.
Hierdie video wys vir ons die verskillende wyses waarop partikels optree in die vaste-, vloeistof- en gastoestande.
Die vaste toestand
Vaste stowwe behou hul vorm en kan nie saamgepers word nie. Kom ons kyk of die deeltjiemodel ons kan help om te verstaan waarom vaste stowwe hulle so gedra.
In 'n vaste stof is die partikels dig opmekaar in vaste posisies gepak. Hulle is in posisie vasgevang en dit verklaar waarom vaste stowwe 'n vaste vorm het. Kyk na die volgende beelde van natriumchloried (tafelsout). Onthou jy die formule vir natriumchloried?
Natriumchloried is NaCl. Vra leerders waarom hulle dink die chloriedatome die groter pers atome en die natriumatome die kleiner geel atome in die submikroskopiese voorstelling in die tabel is. Die kleur maak nie saak nie, solank al dieselfde atome dieselfde kleur is. Die groottes dui egter daarop dat die chloriedatome groter as die natriumatome is, soos gesien kan word uit hul posisie in die Periodieke Tabel. Wys dit vir die leerders uit as jy 'n Periodieke Tabel in die klas opgeplak het, of laat hulle na die tabel voor in hulle boeke kyk.
Makroskopiese beeld van natriumchloried | Submikroskopiese voorstelling van natriumchloried |
 |  |
Tafelsoutkristalle is hard en het 'n vaste vorm. | Kan jy sien hoe die chloriedatome (pers) en die natriumatome (geel) mekaar in 'n vaste rangskikking afwissel? |
Kyk mooi na die beeld van die partikels in 'n vaste stof (tafelsout) hierbo. Jy sal sien dat hulle in 'n reëlmatige rangskikking gepak is. Daar is baie klein spasies tussen die partikels in 'n vaste stof.
Partikels word deur aantrekkingskragte bymekaargehou. In vaste stowwe is hierdie kragte sterk genoeg om die partikels stewig in posisie te hou.
Beteken dit dat die deeltjies in 'n vaste stof glad nie beweeg nie? Nee. Die partikels in 'n vaste stof beweeg effens. Hulle vibreer in hulle vaste posisies. Hoe meer energie die partikels besit, hoe vinniger en sterker vibreer hulle.
Sien jy hoe ons die deeltjiemodel gebruik het om die eienskappe van vaste stowwe te verklaar wat ons kan waarneem? Byvoorbeeld, die feit dat partikels in vaste stowwe diggepak is en sterk kragte tussen hulle het, verklaar waarom vaste stowwe 'n vaste vorm het en jy hulle nie kan saampers nie.
Die vloeistoftoestand
'n Belangrike eienskap van vloeistowwe is dat hulle vloei. Hulle vul houers waarin hulle geskink word. Vloeistowwe is ook nie baie saampersbaar nie. Hoe kan hierdie eienskappe verklaar word?

In die vloeistoftoestand het partikels nie vaste posisies nie. Hulle beweeg vrylik rond, maar bly naby mekaar, want die aantrekkingskragte tussen hulle is taamlik sterk, maar nie so sterk soos in vaste stowwe nie.
Het jy opgelet hoe 'n vloeistof altyd die vorm aanneem van die houer waarin dit is? Binne-in die vloeistof glip en gly die partikels verby mekaar. Dit is waarom vloeistowwe vloei. Hulle partikels is vry om rond te beweeg en die spasies wat deur ander partikels gelaat is, te vul. Kyk na die foto van die lemoensap wat geskink word. Kom ons zoem in en kyk wat die partikels besig is om te doen terwyl die sap geskink word.

Die partikels in 'n vloeistof het klein spasies tussen hulle, maar nie so klein soos in vaste stowwe nie. Die partikels in 'n vloeistof is losweg gerangskik, wat beteken dat hulle nie vaste vorms soos vaste stowwe het nie, maar eerder die vorm van die houer waarin hulle is, aanneem.
Die spoed waarteen die partikels binne-in die vloeistof rondbeweeg, hang van die energie van die partikels af. Wanneer ons 'n vloeistof verhit, gee ons die partikels meer energie en versnel hulle.
In gasse beweeg die partikels nog vinniger.
Die gastoestand
Gasse versprei vinnig om die hele ruimte wat vir hulle beskikbaar is, te vul. Dink aan wanneer jy 'n ballon opblaas. Die lug wat jy in die ballon inblaas, vul die hele ballon. 'n Gas sal die hele ruimte tot sy beskikking vul. Dit is omdat die partikels in 'n gas geen bepaalde rangskikking het nie.
Gasse het nie 'n vaste vorm nie. Dink weer aan die ballon: die gas vul die hele ruimte binne-in die ballon. Jy kan die ballon vasdruk en sy vorm verander.
Gaspartikels beweeg baie vinnig, baie vinniger as in vaste stowwe en vloeistowwe. Die partikels in 'n gas besit baie energie.
Het jy al probeer om die gas in 'n spuit of in 'n fietspomp saam te pers? Waarom dink jy kan jy die gas saampers?
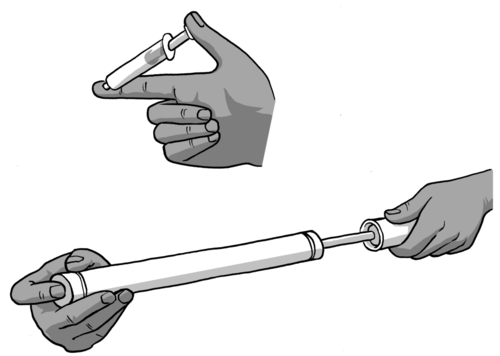
Hierdie is 'n goeie demonstrasie vir leerders om uit te probeer. Spuite is goedkoop en by die meeste apteke beskikbaar. Gee aan elke leerder drie spuite. Laat hulle een met sand vul, een met water en een met lug. Hulle maak dan die tuit van elke spuit styf toe met rubber of die vinger en druk die suier in. Laat hulle waarneem en hul waarnemings probeer verduidelik.
In gasse is die kragte tussen partikels baie swak. Dit verklaar waarom die partikels in gasse nie netjies gerangskik is nie. Hulle word nie styf bymekaargehou nie en daar is groot spasies tussen hulle. Hierdie spasies is baie groter as in die vaste- en vloeistoftoestand.
Gasse kan saamgepers word, want hulle partikels kan gedwing word om nader aan mekaar te kom. Kyk na die foto van 'n skubaduiker onder die water. Sien jy die tenk op sy rug? Hy gebruik hierdie tenk om onder die water asem te haal. 'n Skubaduiker kan vir amper 'n uur onder water bly. Hoe dink jy kan hy genoeg lug van so 'n klein tenk kry om vir 'n hele uur asem te haal? Bespreek dit met jou klas.
Die antwoord is dat die lug saamgepers is sodat baie meer lug in die tenk inpas as wanneer die lug nie saamgepers sou wees nie.

Kom ons som op wat ons geleer het van dit wat die deeltjiemodel van materie vir ons sê van vaste stowwe, vloeistowwe en gasse.
Vergelyking van vaste stowwe, vloeistowwe en gasse
INSTRUKSIES:
Gebruik die voorstellings van die verskillende toestande om jou te help, en gaan weer deur die inhoud in jou werkboek.
Vaste stof  | Vloeistof  | Gas 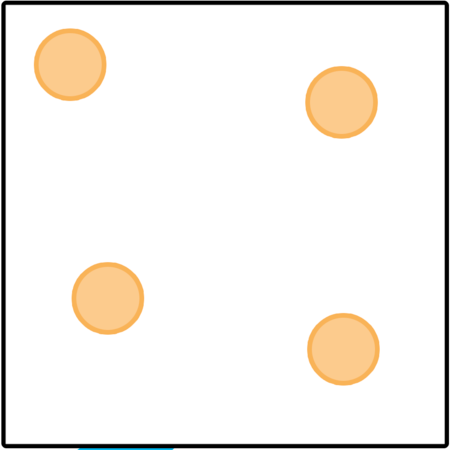 | |
Rangskikking van partikels | |||
Beweging van partikels | |||
Kragte tussen partikels | |||
Spasies tussen partikels |
Vaste stof  | Vloeistof  | Gas 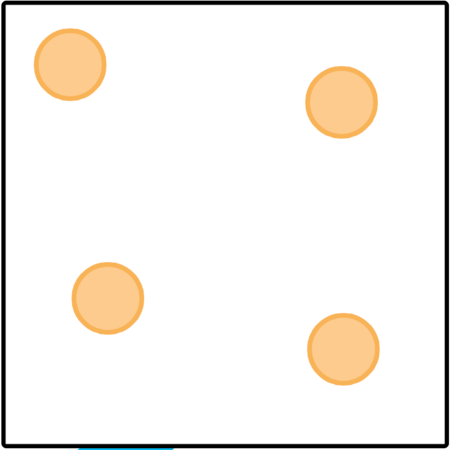 | |
Rangskikking van partikels | Diggepak in 'n reëlmatige rangskikking | Losweg gerangskik, maar nog naby mekaar | Geen bepaalde rangskikking |
Beweging van partikels | Beweeg nie; vibreer net | Kan taamlik vinnig beweeg en by mekaar verbygly | Beweeg baie vinnig |
Kragte tussen partikels | Baie sterk kragte tussen hulle | Sterk kragte, maar swakker as in die vaste toestand | Baie, baie swak kragte tussen die partikels |
Spasies tussen partikels | Baie klein spasies | Klein spasies | Baie groot spasies |
VRAE:
Hierdie is uitbreidingsvrae om seker te maak dat leerders dit wat hulle in verband met die deeltjiemodel van materie geleer het, kan gebruik om die waarneembare eienskappe van vaste stowwe, vloeistowwe en gasse te verklaar.
Vaste stowwe het 'n vaste vorm omdat hul partikels in 'n vaste rangskikking gerangskik is en hulle sterk kragte het wat hulle bymekaarhou, en die vorm van die vaste stof dus vas bly. Die partikels van 'n gas het nie enige bepaalde rangskikking nie en die kragte tussen hulle is baie, baie swak. Die partikels in 'n gas kan dus maklik rondbeweeg en die vorm van die houer waarin hulle is, vul, wat beteken dat hulle geen vaste vorm het nie.
Die partikels in 'n gas het baie groot spasies tussen hulle, sodat die partikels nader aan mekaar opgedruk kan word, wat beteken dat die gas maklik saamgepers kan word om 'n kleiner volume te beslaan. Vloeistowwe het baie klein spasies tussen die partikels en dit is dus baie moeiliker om hulle opmekaar te druk, en hulle word dus nie maklik saamgepers nie.
Die koekmeel is nie 'n vloeistof nie, maar 'n vaste stof. Meel, en alle poeiers, is vaste stowwe wat bestaan uit baie fyn korrels wat vrylik kan vloei wanneer hulle houer skuins gehou of geskud word. Maar hierdie korrels is 'n vaste stof.
Hierdie is 'n moeilike vraag en jy behoort dit in die klas te bespreek. Dit is 'n algemene wanbegrip by leerders dat poeiers vloeistowwe is omdat jy hulle kan 'skink' en hulle die vorm van die houer waarin hulle is, aanneem. Hulle is NIE vloeistowwe nie. Wys die leerders daarop dat jy nie poeiers kan laat verdamp soos met 'n vloeistof nie, en die poeier maak nie jou vingers nat wanneer jy daaraan raak nie.
'n Video wat die verskil tussen die vaste-, vloeistof- en gastoestande van materie verduidelik
Diffusie
Het jy al opgelet hoe vinnig reuke trek. Dalk het jy al by 'n vullisdrom verbygestap en die vullis geruik.


Het jy al ooit 'n stinkbom geruik? Hoe kom die 'stinkbom' of die 'vullis' partikels by jou neus uit wanneer jy hierdie goed ruik?
Laat leerders kortliks bespreek waarvoor stinkbomme gebruik word. Hulle sou kon sê dat 'n stinkbom gebruik kan word om 'n poets te bak. Die stinkende partikels meng met die lug en as ons asemhaal, ruik ons hulle.
Die meeste reuke trek vinnig, omdat hulle partikels met lug meng en in ons neuse kom wanneer ons asemhaal. Ons sê dat die partikels deur die lug diffundeer.
In Gr. 7 het ons van verskillende tipes mengsels geleer. In die volgende ondersoek gaan ons uitvind of partikels vinniger meng wanneer hulle in die vloeistoftoestand of in die gastoestand is. Dit word die tempo van diffusie genoem. Wat sou jou voorspelling wees?
Wanneer ons van 'n tempo praat, is ons besig om te meet hoe iets verander in verhouding tot 'n ander faktor, soos byvoorbeeld tyd. 'n Ander voorbeeld is spoed, gemeet in km/h - dit is 'n tempo van die verandering van afstand in kilometers oor 'n periode van tyd (ure).
Vergelyking van die diffusie van partikels in 'n gas en in 'n vloeistof
ONDERSOEKENDE VRAE:
- Diffundeer (meng) partikels vinniger wanneer hulle in die vloeistoftoestand of in die gastoestand is? Watter partikels sal vinniger meng: gasse of vloeistowwe?
- Diffundeer partikels vinniger met of sonder vermenging?
Dit is op hierdie vlak voldoende om die diffusietempo's van gasse en vloeistowwe kwalitatief te vergelyk. Ons sal nie 'n gekontroleerde kwantitatiewe vergelyking van die diffusietempo's uitvoer nie. Dit sou moontlik wees om die ondersoek na 'n gekontroleerde eksperiment te verander indien jy identiese houers gebruik om die diffusietempo's te vergelyk, en gasse en vloeistowwe met soortgelyke partikelgrootte sou vergelyk. Dit sou dan ook nodig wees om 'n gekleurde gas (bv. broomgas) te kies sodat leerders die diffusieproses se vordering in die houer kan waarneem. Dit is belangrik om daarop te let dat broom 'n gevaarlike gas is en nie vrylik bekombaar is nie. Hierdie voorbeeld sou slegs aanbeveel word indien jy die fasiliteite en opleiding het om veilig met broom te kan werk. 'n Alternatiewe stof wat die diffusie van gasse effektief sal demonstreer, is waterstofsulfied (H2S). 'n Paar druppels soutsuur op ystersulfied of natriumsulfied in 'n koniese fles, sal H2S lewer. Dit kan in plaas van die vanielje geursel gebruik word. Dit is belangrik om daarop te let dat H2S 'n baie sterk, slegte reuk het (tipiese vrot eier reuk). Dit is nie by lae konsentrasies toksies nie, maar dit is belangrik om seker te maak dat die kamer goed geventileer is en dat die vensters oop is. Dit sou nie ideaal wees om H2S te gebruik as die klaskamer baie klein of vol is nie. Jy kan ook 'n 'rookbom' (beskikbaar by speelgoedwinkels) buite die klaskamer aansteek as dit by jou skool toegelaat word. Die rook wat met die lug meng is 'n effektiewe analoog van gasse wat vermeng, alhoewel die rook in werklikheid fyn, vaste roetpartikels bevat en streng gesproke nie 'n gas is nie.
Indien daar tyd is, word aanbeveel dat jy die eksperiment waarin gasse gemeng word, herhaal (met vanielje geursel in 'n piering), maar op 'n ander dag. Tydens die herhaling van eksperimente moet leerders toegelaat word om die reukpartikels na die agterkant van die klaskamer te waai met hulle arms. Doen dit op 'n ander dag om die vanillareuk toe te laat om tussen eksperimente van die klaskamer en die leerders se sensoriese reseptore te ontsnap.
HIPOTESE:
Wat is jou voorspellings? Verwag jy dat vloeistowwe vinniger sal meng as gasse, of andersom? Sal die tempo waarteen gasse meng beïnvloed word deur dit te roer? Skryf jou hipotese hieronder neer.
IDENTIFISEER VERANDERLIKES:
Hierdie is nie 'n gekontroleerde eksperiment nie, aangesien ons nie die tempo's van vermenging van die vloeistowwe en gasse onder presies dieselfde kondisies meet nie. Ons sal 'n eenvoudige vergelyking van die tempo's van vermenging maak, deur te kyk hoe lank dit elkeen neem om onder twee verskillende stelle toestande te meng.
MATERIALE EN APPARAAT:
- groot glasbeker of ander groot deursigtige glashouer
- drupper
- voedselkleursel of ink
- kraanwater
- vanielje geursel
- vlak bak of piering
METODE:
Deel 1: Hoe vinnig meng vloeistowwe?
- Vul 'n groot, deursigtige houer met kraanwater en sit dit waar almal dit kan sien.
- Gebruik 'n drupper om een of twee druppels voedselkleursel in die water te drup.
- Noteer die tyd wanneer die kleursel by die water gevoeg word.
- Kyk mooi na die twee vloeistowwe wat meng, en skryf jou waarnemings hieronder neer. Laat die vloeistowwe toe om te meng sonder om dit te roer.
- Noteer die tyd wanneer die vloeistowwe heeltemal gemeng is, met ander woorde, wanneer die kleur uniform deur die water versprei is.
Vloeistowwe meng relatief stadig wanneer hulle nie geroer word nie. Dit is heel moontlik dat die vloeistowwe teen die einde van die les nog nie volledig gemeng het nie, en die leerders moet dit as 'n waarneming aanteken. Herinner hulle om die volgende dag na te gaan of die kleur al uniform deur die water versprei het.
Deel 2: Hoe vinnig meng gasse?
Hierdie eksperiment moet uitgevoer word met die vensters toegemaak.
Sê die leerders om die lug te ruik en sodra hulle die vanielje geursel kan ruik, saggies die hand op te steek (sonder om dit rond te waai). Vra die leerders vooraf waarom hulle nie moet beweeg terwyl die vanielje geurselpartikels besig is om deur die klaskamer te beweeg nie. Antwoord: dit sou dieselfde wees as om die mengsel te roer, wat dit vinniger sal laat meng. Dit sou dus nie 'n billike toets wees nie.
Een leerder kan die taak gegee word om die tye op die bord te skryf.
- Gooi 'n bietjie vanielje geursel in die piering.
- Noteer die tyd wanneer die vanielje geursel geskink word.
- Noteer die tyd wanneer die eerste leerder sy/haar hand opsteek.
- Noteer die tyd wanneer min of meer die helfte van die leerders hulle hande opgesteek het.
- Noteer die tyd wanneer die leerders agter in die klas die vanielje geursel vir die eerste keer ruik.
- As daar genoeg tyd is gedurende julle volgende Natuurwetenskappe les, herhaal stappe 1-5. Julle moet alles presies dieselfde doen, maar hierdie keer moet almal hulle arms beweeg en probeer om die lug na die agterkant van die klas te 'waai'.
Hierdie is 'n geleentheid vir leerders om te sien hoe die mengtyd beïnvloed word wanneer hulle die lug en vanielje geurselpartikels aktief meng. Vra hulle om te voorspel of die reuk vinniger of stadiger sal trek al dan nie, en om moontlike redes hiervoor te bespreek.
RESULTATE EN WAARNEMINGS:
Leerders moet neerskryf wat hulle sien. Hierdie is moontlike waarnemings:
- Dit neem lank vir die twee vloeistowwe om te meng;
- Dit lyk asof die voedselkleursel ronddraai in die water.
- Aan die begin is sommige dele van die water donkerder gekleur as ander.
Hoe lank het dit geneem vir die vloeistowwe om volledig te meng totdat die kleur uniform deur die water versprei was?
Indien die vloeistowwe teen die einde van die les nog nie volledig gemeng het nie, moet leerders dit as 'n waarneming aanteken.
Toe die lug NIE gedurende die eksperiment gemeng is nie:
- Hoe lank het dit geneem voordat die eerste leerders die vanielje geursel geruik het?
- Hoe lank het dit geneem totdat die laaste leerders die vanielje geursel geruik het?
Leerder/klas-afhanklike antwoorde.
Toe die lug WEL gedurende die eksperiment gemeng is:
- Hoe lank het dit geneem voordat die eerste leerders die vanielje geursel geruik het?
- Hoe lank het dit geneem totdat die laaste leerders die vanielje geursel geruik het?
Leerder/klas-afhanklike antwoorde.
Teken 'n tabel met jou resultate vir die eksperiment met vanielje geursel. Jy kan jou eie opskrifte vir die kolomme en rye kies. Onthou om ook vir jou tabel 'n opskrif te gee.
'n Voorbeeld van die tipe tabel wat leerders kan teken, word hieronder gegee.
Tabel om die waarnemings te toon vir die ruik van vanielje geursel met en sonder vermenging van die lug.
Gebeurtenis | Tyd gemeet sonder vermenging (minute) | Tyd gemeet met vermenging (minute) |
Die eerste leerder het die vanilla geruik | ||
Omtrent die helfte van die klas het die vanilla geruik | ||
Leerders agter in die klas het die vanilla geruik. |
ANALISE EN EVALUERING:
Leerder-afhanklike antwoord.
Leerder-afhanklike antwoord.
GEVOLGTREKKINGS:
Wat is jou gevolgtrekkings? (Wat is jou antwoorde op die ondersoekende vrae?)
Leerders behoort tot die gevolgtrekking te kan kom dat gasse vinniger as vloeistowwe diffundeer, en dat die diffusietempo versnel word as jy die lug of vloeistof meng of roer.
Ons het in hierdie eksperiment die tempo's waarteen partikels diffundeer, ondersoek. Wat dink jy gebeur op partikelvlak wanneer twee stowwe meng?
Vra die leerders om dit kortliks in groepies te bespreek. Herinner hulle aan hul waarnemings toe die voedselkleursel met die water gemeng is. Sommige idees om te noem:
- Wanneer stowwe meng, vermeng hul partikels.
- Die proses is nie onmiddellik nie, maar neem tyd, omdat dit behels dat die partikels van een punt na 'n ander moet beweeg. (Vra die leerders of hulle dink partikels sal in 'n reguit lyn beweeg. Wat gebeur as 'n gaspartikel teen 'n 'lugpartikel' bots?)
'n Interessante video wat verduidelik wat diffusie is en hoe dit plaasvind.
Ons sien in die foto's hoe 'n geel vloeistof by 'n kleurlose een gevoeg word. Let op hoe die geel vloeistof draai en uitsprei soos die geel partikels met die kleurlose partikels meng. Ons kan natuurlik nie die partikels sien nie, maar ons kan 'n makroskopiese waarneming (iets wat ons met die blote oog kan sien) van die proses maak.




Hoe sal die mengsel lyk as die gekleurde partikels uniform versprei is tussen die watermolekules?
Die mengsel sal regdeur dieselfde kleur hê. Die laaste foto is amper so, maar nie heeltemal nie.
Hoe sal die mengproses op partikelvlak daar uitsien? Die volgende diagram gee 'n voorstelling van een van die glase wat hierbo uitgebeeld word, en wat 'n kleurlose vloeistof (deur die blou sirkels verteenwoordig) bevat waarby 'n geel vloeistof (deur die geel sirkels verteenwoordig) gevoeg word. Die glas links toon die partikels in die mengsel direk nadat die geel vloeistof by die kleurlose vloeistof gevoeg is. Die glas regs is leeg. Teken die partikels in die mengsel nadat die geel vloeistof uniform dwarsdeur die kleurlose vloeistof versprei het.
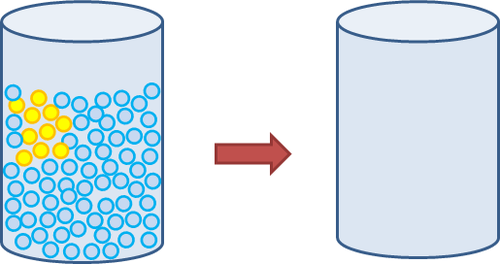
Dit is soos die laaste tekening moet lyk. Let daarop dat daar 10 geel partikels in die laaste houer moet wees. Hulle moet min of meer eweredig tussen die kleurlose partikels versprei wees.

Toe jy in die laaste ondersoek gekyk het hoe die gekleurde vloeistof met die water meng, was dit moontlik om die rigting te voorspel waarin die kleur sou draai? Wat het die twee vloeistowwe laat meng?
Nee, dit is nie moontlik om te voorspel hoe die voedselkleursel/gekleurde vloeistof sal draai nie.
Willekeurige beweging van partikels
Die partikels in vloeistowwe en gasse is gedurig aan die beweeg. Hulle bewegings is onvoorspelbaar: ons sê die partikels beweeg willekeurig. Dit is die willekeurige beweging van die partikels wat vloeistowwe en gasse laat diffundeer.
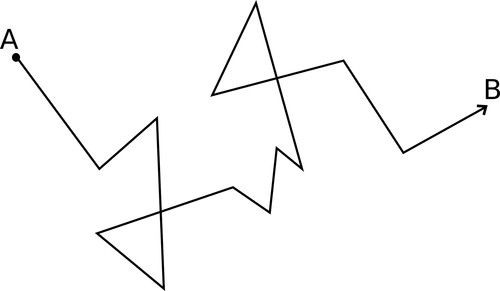
Die volgende sigsagdiagram verduidelik wat bedoel word met 'willekeurige' beweging. Wanneer 'n partikel beweeg van punt A na punt B, sal dit langs die pad teen baie ander gaspartikels bots - tot agt biljoen botsings elke sekonde! Slegs 'n paar van daardie botsings word in die diagram getoon. Elke keer wat die partikel bots, sal dit van rigting verander. Dit beteken dat die werklike afstand wat die partikel aflê baie verder is as die direkte afstand tussen punte A en B.
Hier moet ons versigtig wees om nie woorde te gebruik wat leerders met die indruk laat dat die partikel 'n 'wil' het, of 'doelgerig' beweeg nie. Partikels beweeg willekeurig. As daar net een partikel was, sou dit in werklikheid 'n toevallige pad kon volg by die venster uit! Dit is omdat daar so baie partikels is wat in alle rigtings beweeg, dat sommige van hulle mettertyd ons neuse sal bereik, of die ander kant van die klaskamer.
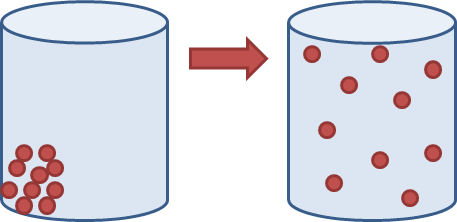
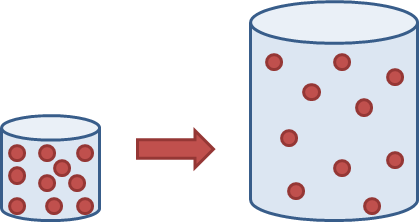
Die proses wat verantwoordelik is vir die vermenging en verspreiding van partikels in 'n gas and vloeistof, word diffusie genoem. Ons kan diffusie definieer as die willekeurige beweging van vloeistof- of gaspartikels van 'n hoë konsentrasie na 'n lae konsentrasie om egalig te versprei.Die volgende diagram illustreer die idee op 'n baie eenvoudige manier: dit wys hoe die partikels in 'n gas mettertyd uitsprei om die hele beskikbare ruimte te vul.
Faktore wat die tempo beïnvloed waarteen partikels diffundeer
Die spoed waarteen partikels diffundeer hang van verskeie faktore af, naamlik:
- Die massa van die partikels: ligter partikels sal vinniger diffundeer omdat hulle oor die algemeen vinniger beweeg.
- Die toestand van die partikels: die partikels in 'n gas beweeg altyd vinnig; ons sê hul gemiddelde spoed is hoog. Die partikels in 'n vloeistof beweeg stadiger.
- Die temperatuur van die partikels: temperatuur is 'n maatstaf van die kinetiese energie van die partikels. Hoe hoër die temperatuur, hoe meer energie het die partikels en hoe vinniger sal hulle beweeg en diffundeer.
- Die grootte van die spasies tussen partikels: As daar groot spasies tussen die partikels van een stof is, kan die partikels van 'n ander stof maklik in daardie spasies inbeweeg.
Partikels diffundeer omdat hulle in konstante beweging is. Ons het in die laaste ondersoek gevind dat gaspartikels baie vinniger as vloeistofpartikels gediffundeer het. Kan ons daardie resultaat verklaar aan die hand van die faktore wat hierbo genoem is?
Jy kan 'n praktiese demonstrasie hiervan in die klas met jou leerders doen. Laat 'n groep leerders in die middel van 'n oop ruimte staan. Laat hulle eerstens die partikels in 'n vloeistof simuleer, sodat hulle redelik naby mekaar is, maar steeds kan rondbeweeg. Laat ander leerders dan tussen die groep leerders in die middel deurbeweeg. Laat 'n klompie leerders dit doen sodat almal 'n beurt kry. Laat die leerders in die middel dan die partikels in 'n gas simuleer deur heelwat verder uit te sprei en baie meer rond te beweeg. Hulle kan ook teen mekaar bots. Die ander leerders moet weer deur die middelste groep beweeg, wat nou vir hulle heelwat makliker en vinniger behoort te wees om te doen.
Dink so daaraan: verbeel jou jy probeer deur 'n skare mense beweeg. Hoe nader hulle bymekaar is, hoe meer dikwels sal jy van rigting moet verander om deur die skare te kom en hoe langer gaan dit neem om by jou bestemming uit te kom.

'n Partikel in 'n vloeistof kan nie baie ver beweeg voordat dit teen 'n ander partikel bots nie, omdat die partikels so naby mekaar is. Dit beteken dat die vloeistofpartikels gedurig besig is om te bots en met elke botsing in 'n nuwe rigting gestuur te word. Dit beteken die tempo van diffusie is heelwat stadiger in vloeistowwe as in gasse, omdat die partikels van 'n gas verder uitmekaar is en baie minder bots. Gaspartikels kan baie verder beweeg voordat hulle in 'n ander rigting gestuur word deur 'n botsing. Dit is waarom gasse vinniger diffundeer.
Die volgende tabel toon soortgelyke sigsagtekeninge as wat jy voorheen gesien het, maar nou kan jy die verskil sien tussen die willekeurige beweging van 'n partikel deur 'n vloeistof en deur 'n gas. Dit sal die partikel veel langer neem om van A na B in die vloeistof as in die gas te beweeg.
Vloeistof | Gas |
 | 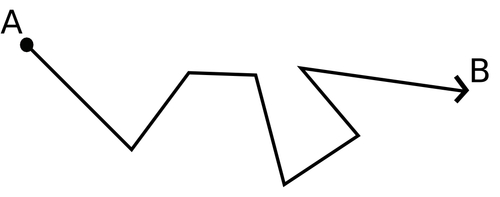 |
Noudat ons 'n beter idee van die gedrag van partikels in die verskillende toestande van materie het, is ons gereed om te kyk na hoe partikels optree wanneer materie van toestand verander.
Veranderinge van toestand
- damp
- kragtig
- energiek
- transformasie
- kondensasie
- verdamping
In wetenskap verwys 'n verandering in toestand na 'n verandering in fisiese toestand (bv. wanneer 'n vloeistof na 'n vaste stof verander). Wat word hierdie proses genoem?
Vriesing
Dit is altyd 'n goeie idee om nuwe dinge te leer in terme van dit wat ons reeds weet. Ons gaan hierdie afdeling met 'n paar vinnige vrae begin om te hersien wat ons reeds weet van toestandsveranderinge.
Veranderinge van toestand
Hierdie is 'n opsionele hersieningsoefening van dit wat in vorige grade behandel is.
INSTRUKSIES:
- Beantwoord die vrae hieronder.
- Al die vrae handel oor toestandsveranderinge in materiale.
Hier is die vrae:
-
As ons stoom na water wil verander, moet ons dit _____.
-
Die proses waarin 'n vloeistof na 'n gas verander word _____ genoem.
-
Die partikels van 'n _____ het groot spasies tussen hulle.
-
Die partikels van 'n _____ word deur sterk kragte in posisie gehou.
-
'n Vaste stof sal na die vloeistoftoestand verander by sy _____punt.
-
Die vloeistoftoestand van ys word _____ genoem.
-
Die gastoestand van ys word _____ genoem.
-
As ons water na stoom wil verander, moet ons dit _____.
-
Die proses waarin 'n gas verander word na 'n vloeistof, word _____ genoem.
-
Die partikels van 'n _____ is naby mekaar, maar hulle kan oor mekaar vloei en gly.
-
Die kookpunt van 'n vloeistof is die temperatuur waarby daardie vloeistof sal begin _____.
-
Die vaste toestand van water word _____ genoem.
-
Vriesing en smelting is die _____ van mekaar.
-
Water word in ys verander deur dit te _____.
Hier is die antwoorde op bogenoemde vrae: 1. afkoel; 2. verdamping; 3. gas; 4. vaste stof; 5. smelt; 6. water; 7. stoom (waterdamp); 8. verhit; 9. kondensasie; 10. vloeistof; 11. kook; 12. ys; 13. omgekeerde; 14. vries.
Hoe kan ons materie van een toestand na 'n ander verander?
Laat die leerders in die klas aan 'n paar idees dink. Jy moet hulle uiteindelik lei om te besef dat alle veranderings van toestand verandering in energie behels.
Wanbegrippe oor temperatuur (video).
Toestandsveranderinge behels energie
Vir materie om van een toestand na 'n ander te verander, moet sy partikels energie verkry of verloor. Die volgende diagram wys ons dat 'n stof óf verhit óf afgekoel moet word om sy toestand te verander.
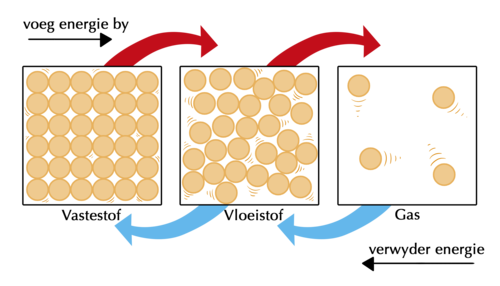
Vra die leerders wat hulle dink die klein lyntjies om die partikels voorstel in die figuur hierbo. Die lyntjies raak groter en verder uitmekaar soos die partikels gaan van vaste stof na vloeistof na gas. Hulle stel die hoeveelheid beweging in die partikels voor, soos ons in die volgende inhoud sal bespreek. Die kinetiese energie van die partikels neem toe soos jy energie toevoeg, en neem af as jy energie verwyder.
Laat ons eerstens kyk na wat met partikels gebeur wanneer hulle verhit word.
Smelting en verdamping
- kook
- smelting
- verdamping
- smeltpunt
- kookpunt
'n Voorstel is om ys klas toe te bring en dit in 'n bakkie te laat smelt sodat die leerders dit kan waarneem. Wanneer al die ys gesmelt het, kan jy die bakkie op 'n warm plek sit sodat die volgende toestandsverandering kan plaasvind en die water verdamp.
Wanneer 'n vaste stof verhit word om sy smeltpunt te bereik, sal dit na 'n vloeistof verander. Dit is 'n proses wat aan ons almal bekend is, want ons het al gesien hoe ys smelt.

Vir 'n vaste stof om na 'n vloeistof te verander, moet die partikels in die vaste stof vrygelaat word uit hulle vaste posisies in die vaste toestand. Hoe kan dit plaasvind?
Stel jou voor jy hou hande vas met 'n groep leerders. Almal spring op een plek, iets soos 'n partikel van 'n vaste stof wat in 'n vaste posisie vibreer. Hoe meer energiek en willekeurig almal spring, hoe moeiliker sal dit wees vir almal om steeds hande vas te hou.
'n Voorstel is dat jy hierdie vinnige en eenvoudige demonstrasie met jou leerders doen. Laat hulle in groepe staan en hande vashou. Hulle kan begin deur te wieg en hulle voete te beweeg. Dan kan hulle begin spring. Dan kan hulle begin om hoër te spring en hul lywe te draai totdat hulle nie meer mekaar se hande kan vashou nie. Sulke prettige, interaktiewe leeraktiwiteite maak die les interessanter en help dat leerders die konsepte beter onthou. Wanneer hulle op een plek staan, maar wieg en effens beweeg terwyl hulle hande vashou, verteenwoordig dit die vaste toestand. Wanneer hulle nie meer hande hou nie en kan rond beweeg, verteenwoordig dit die vloeistoftoestand. En eindelik, om verdamping te wys: leerders begin een op 'n slag hardloop/rondbeweeg. Laat hulle vinniger en vinniger hardloop, en dan wegbreek van die wiegende/springende/bewegende leerders in die groep - dit verteenwoordig 'n partikel wat verdamp het en nou in die gasfase is.
Wanneer 'n stof verhit word, verkry die partikels meer energie. Deur aan vibrerende partikels in 'n vaste stof meer energie te gee, sal hul vibrasies al hoe meer kragtig word, totdat die vaste partikels in staat is om hulself los te skud uit hul vaste posisies. Die kragte tussen die partikels is nie langer in staat om hulle styf bymekaar te hou nie, en die vaste stof smelt.
Wat sal gebeur as ons selfs nog meer energie aan die partikels toevoeg? Die partikels (wat nou in die vloeistoftoestand is) sal al hoe vinniger rondrits soos hulle warmer word. Gou sal sommige van die partikels naby die oppervlak genoeg energie hê om uit die vloeistof te ontsnap. Sodra hulle vry is van die kragte wat hulle in die vloeistoftoestand bymekaarhou, gaan hulle oor in die gastoestand. Die gastoestand word soms die dampfase genoem, wat vorm wanneer 'n vloeistof verdamp. Dit is waarom die gastoestand van water soms waterdamp genoem word.
Hoe hoër die temperatuur van die vloeistof, hoe vinniger sal dit verdamp. 'n Waterplassie sal baie vinniger van 'n warm sypaadjie verdamp as van 'n koel kombuisvloer! Waarom dink jy hang ons wasgoed buite in die son om droog te word?
Bespreek dit met jou klas. Hulle mag eenvoudig antwoord dat die sonlig die wasgoed gouer droogmaak, maar vra hulle waarom hulle dink dit gebeur. Dit is omdat die hitte van die son die molekules van die water wat in die klere is, verwarm. Wanneer die watermolekules verhit word, verkry die molekules genoeg energie om van hul vloeistoftoestand te ontsnap en die water verdamp. Hierdie verdamping sal baie vinniger buite, in sonskyn, gebeur as binne. Moedig hulle aan om aantekeninge te maak terwyl julle goed in die klas bespreek.

Is daar 'n verskil tussen verdamp en kook?
Verdamping vind by alle temperature plaas, terwyl iets by 'n spesifieke temperatuur kook, wat die kookpunt genoem word. Wanneer 'n vloeistof tot by sy kookpunt verhit word, vorm borrels in die vloeistof wat na die oppervlak opstyg. Wanneer dit gebeur sê ons die vloeistof kook. Verdamping vind slegs aan die oppervlak van die vloeistof plaas, terwyl die kookposes dwarsdeur die hele vloeistof plaasvind. Kan jy onthou dat julle in Gr. 7 van kookpunte geleer het? Wat is die kookpunt van water by seevlak?
100°C

Kyk mooi na die beeld hierbo van die water wat kook. Wat dink jy is binne-in die borrels?
Leerders mag sê dat die borrels vol gas is. Vra hulle om te sê watter gas. Die borrels is gevul met watermolekules in die dampfase (of gastoestand). Leerders dink dikwels dat watermolekules opbreek in waterstofgas en suurstofgas wanneer water kook. Dit is 'n baie algemene wanbegrip. Hierdie afdeling bied 'n geleentheid vir leerders om te besef dat veranderinge in toestand fisiese veranderinge is. Die molekules (partikels) van 'n stof verander nie hul samestelling gedurende toestandsveranderings nie (dit sou 'n chemiese verandering verteenwoordig). Die partikels is voor en na die toestandsverandering presies dieselfde, hulle is net in 'n ander toestand.
Vervolgens sal ons kyk na die toestandsveranderinge wat kan plaasvind wanneer ons 'n stof afkoel.
Kondensasie en stolling
- kondensasie
- stolling
Wanneer 'n gas verander na 'n vloeistof, word die toestandsverandering kondensasie. genoem. Kondensasie is die omgekeerde van verdamping. Het jy al die klein druppeltjies water opgelet wat aan die buitekant van 'n koue glas water vorm? Hulle word deur kondensasie gevorm.

Wanneer die temperatuur van die gas verlaag word, word energie van die gaspartikels weggeneem. Die beweging van die gaspartikels word stadiger namate hul energie afneem en hulle begin om aantrekkingskragte te ondervind. Hierdie kragte laat hulle nader aan mekaar beweeg en hulle keer uiteindelik tot die vloeistoftoestand terug.
Wat doen groepe mense, diere, of voëls wanneer hulle koud kry? Hulle bondel saam! Op dieselfde wyse kondenseer gaspartikels wat afgekoel word en kom saam om waterdruppels te vorm.

Wat sou gebeur as ons die vloeistof selfs verder afkoel? Deur dit af te koel, verwyder ons energie uit die vloeistof. Namate die vloeistofpartikels energie verloor, beweeg hulle selfs nog stadiger. Namate hul bewegings al hoe stadiger en stadiger word, word die aantrekkingskragte tussen hulle sterker. Die partikels word uiteindelik in posisie 'vasgevang' in die vaste toestand. Hulle kan nie meer vrylik beweeg nie en kan slegs in hul vaste posisies vibreer. Ons sê die vloeistof het gestol.
Die volume van water sit met omtrent 9% uit wanneer dit na ys vries.
Wat gebeur wanneer ons kerswas verhit en dan afkoel?
Hierdie is 'n relatief kort ondersoek om in die klas te doen. Leerders behoort te kan voorspel wat sal gebeur. Die vaardighede waarop hier gefokus word, is die skryf van 'n metode vir 'n ondersoek en die noteer van waarnemings.
Dit kan ook as 'n demonstrasie voor in die klas gedoen word sodat hulle die toestandsveranderinge kan waarneem en hul waarnemings noteer. Leerders moet self die metode beskryf. Hulle kan dit óf in groepe doen en beplan hoe hulle die ondersoek gaan doen, óf die metode vir hulself opskryf nadat jy die demonstrasie voor in die klas uitgevoer het.
Jy kan ook ys in hierdie ondersoek gebruik.
DOEL: Wat is jou doel met hierdie ondersoek?
Om die toestandsveranderinge waar te neem en te noteer wanneer kerswas verhit word en wanneer dit afgekoel word.
HIPOTESE: Wat stel jy voor sal in hierdie ondersoek gebeur? Dit is jou hipotese.
'n Moontlike hipotese is: Die kerswas sal smelt wanneer dit verhit word, en stol wanneer dit weer afgekoel word.
MATERIALE EN APPARAAT:
- leë blikkie of pasteibakkie van foelie
- bunsenbrander of spirituslamp
- driepootstaander
- draadgaas
- kerswas
- vuurhoutjies
METODE:
'n Moontlike metode wat leerders sou kon voorstel, en wat julle in die klas kan volg, is die volgende: (Die stappe in 'n metode moet genommer wees)
- Plaas 'n stuk kerswas in die blikkie/foeliebak
- Plaas die draadgaas op die driepootstaander met die blikkie/foeliebak bo-op die gaas.
- Plaas die bunsenbrander/spirituslamp onder die driepootstaander.
- Steek die bunsenbrander aan en laat die blikkie warm word.
- Neem die verandering in toestand waar terwyl die kerswas warmer word.
- Draai die bunsenbrander se gas af en laat die was weer afkoel.
- Noteer die toestandsverandering.
-
Teken 'n diagram van jou opstelling vir die ondersoek in die spasie hieronder. Onthou om jou diagram van 'n opskrif en byskrifte te voorsien.
Leerders moet netjiese diagramme teken en al die apparaat wat gebruik is, etiketteer. Die etiket-lyne moet parallel en met 'n liniaal getrek wees.
RESULTATE EN WAARNEMINGS:
Dit is 'n vaste stof by kamertemperatuur.
Dit het gesmelt.
Dit het gestol.
Die smeltpunt van kerswas is hoër as kamertemperatuur, want dit is 'n vaste stof by kamertemperatuur en moet verhit word om te kan smelt.
GEVOLGTREKKING:
Skryf 'n gevolgtrekking vir hierdie ondersoek. Jy moet na die deeltjiemodel van materie verwys in jou verduideliking van die toestandsveranderinge wat plaasgevind het.
'n Moontlike gevolgtrekking: Wanneer kerswas verhit word, word energie toegevoeg en die partikels begin al hoe vinniger en vinniger vibreer totdat hulle wegbreek van hulle vaste posisies in die vaste toestand en oorgaan in die vloeistoftoestand, met die gevolg dat die was smelt. Wanneer die was weer afgekoel word, word energie verwyder en die partikels begin al hoe stadiger en stadiger te beweeg totdat die kragte tussen hulle sterk genoeg is om die partikels in vaste posisies vas te vang in die vaste toestand, en die was stol.
In die volgende aktiwiteit gaan ons 'n bietjie pret hê met waterballonne, maar nie op die gewone manier nie. Ons gaan 'n ballon opblaas sonder om daarin te blaas en ons gaan dit binne-in die ballon laat reën! Klink dit soos toorkuns? Nee, net wetenskap!
Warmwaterballon
Hierdie is 'n opsionele aktiwiteit. Jy moet bewus wees van die veiligheidsmaatreëls en die feit dat leerders met warm, kokende materiale werk.
Vir hierdie aktiwiteit sal jy toegang tot 'n mikrogolfoond benodig. Indien jy nie een by die skool of by die huis het nie, sou leerders die aktiwiteit as 'n tuiswerkopdrag kon doen as hulle mikrogolfoonde by die huis het. As alternatief kan die ballon vir 'n paar minute in 'n pot kokende water geplaas word.

MATERIALE:
- groot partytjieballonne (plus 'n paar ekstra)
- 2 teelepels kraanwater
- mikrogolfoond
- oondhandskoene
- skermbril
- groot bak yskoue water
INSTRUKSIES:
Die ballon sit uit.
Dit klink asof dit binne-in die ballon reën.
Die ballon krimp.
VRAE:
Nee, die ballon het nie enige lug in gehad nie, want al die lug is uitgedruk voordat ons dit begin verhit het.
Die ballon het uitgesit omdat die water daarin verdamp het, en dit met damp (gas) gevul het.
Wat is die naam van die gas wat die ballon laat uitsit het?
Waterdamp of stoom.
Let wel: Hier is nog 'n geleentheid om die wanbegrip dat water ontbind in waterstofgas en suurstofgas waneer dit kook, aan te spreek.
Dit het geklink asof dit binne-in die ballon reën.
Waterdruppels wat in die ballon val.
Die waterdamp het in die ballon gekondenseer om druppeltjies vloeibare water te vorm.
Dit het na sy oorspronklike grootte gekrimp.
Verdamping en kondensasie.
Vervolgens gaan ons kyk na drie belangrike eienskappe van materie wat vir wetenskaplikes van nut is, naamlik digtheid, massa en volume. Hierdie drie eienskappe is aldrie verwant aan mekaar.
Digtheid, massa en volume
- massa
- volume
- digtheid
- fisiese hoeveelheid
Jy het waarskynlik al die terme massa en volume vantevore in Natuurwetenskappe en Wiskunde gehoor. Maar wat van digtheid? Het jy al ooit hierdie woord gebruik? Dalk het jy al gehoor iemand beskryf 'n koek as baie dig? Wat beteken dit?
Hierdie afdeling stel ons bekend aan fisiese eienskappe wat belangrik is in die studie van wetenskap. Twee van hierdie eienskappe, naamlik massa en volume, is fundamentele eienskappe van materie. Ons gaan hulle eerste bespreek, en dan sal ons by digtheid kom. Digtheid is ook 'n eienskap van materie en is naby verwant aan die eerste twee.
Massa sê vir ons 'hoeveel' materie ons het
'n Interessante video oor hoe 'n kilogram gedefinieer word (deur die wêreld se rondste voorwerp te gebruik!)
Kyk na die beeld van 'n sak rys. Hoeveel rys is in die sak?
1 kg rys

Die massa van 'n voorwerp of 'n stof sê vir ons uit hoeveel materie dit bestaan. Hoe groter die massa van 'n voorwerp, hoe meer materie bevat dit.
Massa word in kilogram (kg) gemeet. Wanneer ons die massa van klein voorwerpe of klein hoeveelhede materie meet, meet ons dikwels in gram (g) of selfs milligram (mg).
Een kilogram is dieselfde as 1000 gram.
Een gram is dieselfde as 1000 milligram.
Hoeveel milligram is daar in een kilogram?
Doen hierdie berekening op die bord. Leerders moet tussen die eenhede kan wissel. 1000 x 1000 = 1 000 000 milligram in 'n kilogram. Jy kan ook nog voorbeelde doen, soos om te vra hoeveel gram daar in 1.25 kg is (1250 g), en hoeveel milligram in 12.5 gram (12 500 mg)?
As een goudstaaf twee keer die massa van 'n ander goudstaaf het, dan bevat dit twee keer soveel goudatome. Die massa van 'n voorwerp bly dieselfde, ongeag van waar dit is. Tensy 'n stuk daarvan afgesny word, sal dieselfde goudstaaf dieselfde aantal goudatome hê, of dit nou in Gauteng, Bloemfontein, Londen, of die Maan is. Dit beteken die massa sal altyd konstant bly.
Dit verskil fundamenteel van gewig, wat afhanklik is van swaartekrag, en die gewig van 'n voorwerp sal dus verskil op die Aarde en op die Maan. Alledaagse taal verwar soms die terme massa en gewig, veral wanneer van 'liggaamsgewig' gepraat word.

250 g = 0.25 kg.
Volume sê vir ons 'hoeveel ruimte' materie beslaan
Die hoeveelheid ruimte wat 'n voorwerp in beslag neem, word sy volume genoem. Volume word in liter gemeet en word bereken deur die lengte, breedte en hoogte van 'n voorwerp te vermenigvuldig. 'n Liter is die ruimte binne-in 'n kubus wat 10 cm wyd, 10 cm lank en 10 cm diep is.
Wanneer volume bereken word, is 1 cm x 1 cm x 1 cm = 1 cm3. Dit is dieselfde as 1 ml. Dit beteken dat 10 cm x 10 cm x 10 cm = 1000 cm3 wat gelyk is aan 1000 ml of 1 liter.
Wat is die volume melk in die kartonhouer en die volume sap in die bottel in die volgende foto?
Melk is 1 liter en sap is 1.5 liter

Wanneer ons klein volumes meet, gebruik ons milliliter (ml) as die eenheid van volume. 1000 milliliter is dieselfde as een liter.
Digtheid sê vir ons hoe 'diggepak' 'n materiaal is
Digtheid is 'n maatstaf van die massa materiaal wat in 'n gegewe volume inpas. Ons sê digtheid is die verhouding van massa tot volume. Ons kan 'n wiskundige verhouding skryf om hierdie verhouding uit te druk: digtheid = massa/volume
Ons kan ook simbole vir digtheid (D), massa (m) en volume (V) gebruik, dus kan die vergelyking om digtheid te bereken geskryf word as(D = m/V.
As ons twee materiale met dieselfde volume het, sal die materiaal met 'n groter massa digter wees. Dit sal 'n hoër digtheid hê. Ons kan aan digtheid dink as die 'ligtheid' of 'swaarheid' van voorwerpe van dieselfde grootte.
Dink weer aan die sny koek waarvan ons gepraat het as synde dig. Dit is hoe ons die woord digtheid in alledaagse taal kan gebruik. 'n Stuk koek wat as dig beskryf word, sal swaar voel.

In die volgende aktiwiteit gaan ons verskillende materiale wat dieselfde grootte (of volume), maar verskillende digthede het, met mekaar vergelyk.
Watter materiaal is digter?
Hierdie aktiwiteit word nou ingesluit om eers die konsep van digtheid bekend te stel. Ons sal ook weer kyk na die digthede van verskillende materiale. Leerders sal hulle eie ondersoek moet uitvoer, en om deur hierdie tipe aktiwiteit te werk, sal hulle dus help om te dink aan die ontwerp vir die ondersoek in die afdeling oor 'Digthede van verskillende materiale.'
MATERIALE:
'n Verskeidenheid voorwerpe wat dieselfde grootte (volume) het, maar verskillende digthede: spons, polistireen, hout, metaal, baksteen of klip.
As jy sukkel om voorwerpe wat ewe groot is te vind, kan jy begin met 'n paar houers met dieselfde volume en hulle met verskillende stowwe vul. Jy kan byvoorbeeld vuurhoutjiedosies (wat almal dieselfde volume sal hê) gebruik, en hulle met verskillende stowwe soos sand, meel, suiker, watte, ens. vul.
As jy toegang het tot 'n driebalkbalans, kan jy stap 3 hier onder doen en die werklike massa van elke voorwerp bepaal nadat hulle in volgorde van toenemende digtheid gerangskik is. Dit sal help om die verwanskap tussen massa en digtheid te konsolideer.
INSTRUKSIES:
- Hanteer al die verskillende materiale en vergelyk hulle massas. Jy hoef nie hul massas op 'n skaal te bepaal nie. Jy kan net voel hoe swaar hulle in jou hand is.
- Rangskik hulle in volgorde van toenemende digtheid. Doen hierdie aktiwiteit as 'n groep en bespreek waarom sommige materiale digter is as ander.
- As jy toegang het tot 'n driebalkbalans, kan die massa van elk van die voorwerpe gemeet word.
Moedig die leerders aan om die volgende te bespreek: Waarom is die spons so lig? Is daar enige ooreenkomste tussen die voorkoms van 'n spons en die binnekant van 'n brood? Sou dit kon verklaar waarom 'n brood baie ligter is as 'n baksteen van dieselfde grootte? Leerders moet aangemoedig word om ooreenkomste in die tekstuur van stowwe van dieselfde digtheid op te merk. Brood en spons het byvoorbeeld gate of lugholtes binne-in die vaste materiaal. Dit beteken dat hierdie stowwe minder massa per volume-eenheid sal hê as materiale sonder gate.
VRAE:
Jy kan 'n baksteen en 'n brood klas toe bring sodat leerders dit self kan uittoets deur die twee voorwerpe te hanteer.

As hulle dieselfde grootte is, beteken dit dat hulle dieselfde volume het.
Die baksteen het meer massa.
Die baksteen se digtheid sal groter wees. As ons twee voorwerpe van dieselfde grootte vergelyk, sal die een wat swaarder is (meer massa het), 'n groter digtheid hê.
Leer meer oor digtheid met behulp van hierdie simulasie http://phet.colorado.edu/en/simulation/density
Hier is 'n paar wenke vir onderwysers vir die digtheid simulering http://phet.colorado.edu/files/teachers-guide/density-guide.pdf
Digtheid en toestande van materie
Ons het nou geleer van die drie toestande van materie en die eienskappe van elk. Ons weet dat een van die aspekte waarin vaste stowwe, vloeistowwe en gasse van mekaar verskil, te doen het met die afstande tussen die partikels in die onderskeie toestande. Die partikels in gasse is baie verder uitmekaar as die partikels in vloeistowwe of vaste stowwe.
Beteken dit dat die verskillende toestande van materie verskillende digthede het? Ons sal in die volgende aktiwiteit uitvind.
Watter een het die hoogste digtheid: 'n vaste stof, 'n vloeistof of 'n gas?
Hierdie aktiwiteit word gebruik om die algemene eienskap te verduidelik dat vaste stowwe digter is as vloeistowwe, wat digter is as gasse. Daar word genoem dat die houers 'dieselfde materiaal' bevat, wat belangrik is. Water word spesifiek nie in hierdie aktiwiteit genoem nie, omdat dit 'n uitsondering is wat later bespreek sal word. Water tree nie soos ander materiale op nie, aangesien die vaste fase in werklikheid minder dig is as die vloeistoffase in water. Maak seker dat jy nie na water in hierdie aktiwiteit verwys nie.
INSTRUKSIES:
- Vergelyk die drie identiese houers hieronder.
-
Hulle het almal dieselfde volume en bevat dieselfde materiaal
- Houer A bevat 'n vaste stof, houer B bevat dieselfde materiaal in die vloeistoftoestand en houer C dieselfde materiaal in die gastoestand.
- Beantwoord die volgende vrae.
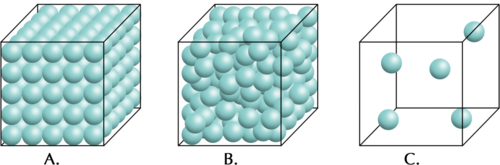
VRAE:
Houer A bevat die meeste partikels en C die minste.
Let wel: As leerders onseker is, kan hulle die aantal partikels in die houers rofweg tel of skat. Hulle moet in gedagte hou dat dit in werklikheid onmoontlik sou wees om die aantal partikels te tel. Dit is belangrik dat hulle besef dat die digtheid van 'n gas aansienlik laer is as die digthede van die ander twee fases.
Die houer met die meeste partikels sal die grootste massa bevat; dus bevat A die grootste massa en C die kleinste.
Die vaste stof het die hoogste digtheid, want dit het die grootste massa. Die gas het die laagste digtheid, want dit het die kleinste massa in dieselfde volume.
Ons het so pas 'n konseptuele aktiwiteit ('n 'dink-aktiwiteit') uitgevoer waarin ons die digthede van die drie toestande van dieselfde materiaal vergelyk het.
Light ice, heavy water! (video)
Indien moontlik, speel die video 'Light ice, heavy water' deur Steve Spangler Science vir jou leerders en vra hulle waarom die ysblokkie dryf en die water sink nadat hulle na die video gekyk het. Jy kan die verduideliking hier lees:http://www.stevespanglerscience.com/experiment/light-ice-cube-heavy-water http://www.stevespanglerscience.com/experiment/light-ice-cube-heavy-water
Jy kan die demonstrasie in die video ook self in die klas doen. Moenie vir die leerders sê dat die 'geheime vloeistof' plantolie is nie, maar laat hulle eerder self probeer om dit te identifiseer.
Die hoë digtheid van 'n vaste stof verklaar waarom dit nie saamgepers kan word nie. Die partikels in 'n vaste stof is diggepak en kan nie nog nader aan mekaar in 'n kleiner volume ingedruk word nie.
Vloeistowwe is ook baie dig. Die digtheid van 'n vloeistof is naastenby dieselfde as die digtheid van die vaste toestand van dieselfde stof. Dit is omdat hulle partikels naby mekaar is, alhoewel hulle nie in vaste posisies vasgevang is nie. Die meeste vloeistowwe kan nie in kleiner volumes saamgepers word nie.
Vloeistowwe is minder dig as hul vaste toestande, maar water is 'n belangrike uitsondering. Het jy al ooit gewonder waarom jou ysblokkies bo-op die water in jou glas dryf?

Die vaste toestand van water (ys) is minder dig as die vloeistof, omdat die watermolekules in ys op 'n unieke manier gepak is. Die beeld links onder toon dat watermolekules in ys so gepak is dat daar oop spasies tussen hulle is. Regs onder word dieselfde watermolekules in die vloeistoftoestand gewys.
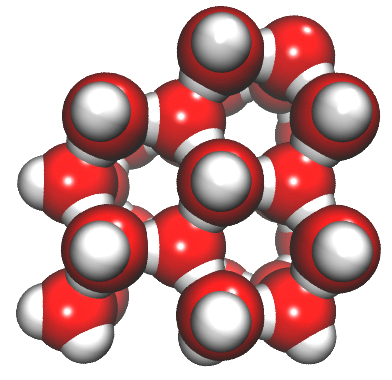
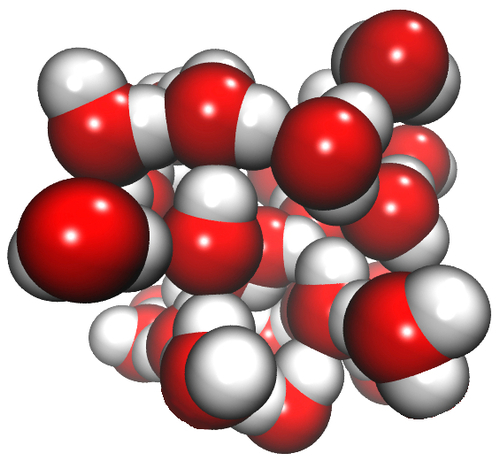
Kan jy sien dat daar groter spasies tussen die watermolekules in die vaste stof as in die vloeistof is? Dit help ook om te verklaar hoe ysberge in die see kan dryf.

Het jy al 'n gevriesde bottel water gesien met die ys wat boontoe uit die bottel gestoot is? Waarom het die water uit die bottel gestoot toe dit na ys verander het?
Wanneer die water vries, het die partikels groter spasies tussen hulle. (Herinner hulle daaraan dat dit 'n unieke en ongewone eienskap van ys is wat nie vir ander vaste stowwe geld nie.) Wanneer dit gevries het, beslaan dieselfde massa water nou 'n groter volume. Water (vloeistof) is digter as ys. Die partikels in water is digter bymekaar gepak. Dit beteken dat meer van hulle in 'n gegewe volume sal inpas.
Gasse is glad nie baie dig nie as gevolg van die groot spasies tussen die gaspartikels. Dit beteken dat hulle 'n klein aantal partikels in 'n groot volume bevat. Dit is waarom gasse saamgepers kan word: hul partikels kan nader aan mekaar gedruk word om in 'n kleiner volume te kan inpas. Dink bietjie terug aan die die lug wat saamgepers word om in 'n gastenk van 'n skubaduiker in te pas.
In die aktiwiteit 'Wat het die hoogste digtheid, 'n vaste stof, 'n vloeistof of 'n gas?' het ons die digthede van verskillende toestande van dieselfde materiaal vergelyk. Dit is 'n maklike vergelyking omdat die partikels in die verskillende toestande identies is. Deur die aantal partikels in dieselfde volume van elke toestand te vergelyk, kan ons die digtheid van elke toestand bepaal.
Dit is effens moeiliker om die digthede van verskillende materiale te vergelyk omdat verskillende materiale uit partikels van verskillende massas bestaan.
Digtheid van verskillende materiale
- tros
- impak
- onmengbaar
Die SI-eenheid vir digtheid is kg/m3. As jy besluit het om die berekeninge van digtheid in hierdie afdeling te doen, sal ons hoofsaaklik g/ml en kg/l as die eenhede vir die meting van digtheid gebruik, aangesien die leerders sal werk met volumes wat hulle in milliliter en liter meet. Dit is ook aanvaarde eenhede vir die meting van digtheid.
Ons gaan nou 'n praktiese aktiwiteit ('n 'doenaktiwiteit') uitvoer om die digthede van 'n vaste stof, 'n vloeistof en 'n gas te vergelyk. Dit sou taamlik moeilik wees om die drie toestande van dieselfde materiaal te vergelyk, aangesien die materiaal by drie verkillende temperature sou moes wees om in die drie verskillende toestande te wees! Daarom sal ons drie verskillende materiale vergelyk: sand, water en lug.
Vergelyking van die digthede van sand, meel, water en lug
ONDERSOEKENDE VRAAG:
Watter materiaal het die hoogste digtheid: sand, meel, water of lug?
Leerders moet self hierdie ondersoek ontwerp. Hulle kan in groepe werk om dit te doen. Hulle moet eers bespreek hoe hulle die ondersoek gaan doen en hulle metode in hul notaboek of op rofwerkpapier neerskryf. Na voltooiing van die ondersoek moet hulle die metode opskryf in die spasie wat hier verskaf word.
Die lys van materiale behoort 'n aanduiding te gee ten opsigte van 'n moontlike prosedure. Aangesien digtheid gegee word deur massa gedeel deur volume, sou leerders die massa van identiese bekers gevul met sand, water en lug kon meet en die benaderde digthede van elke materiaal bereken. As jy nie toegang het tot 'n skaal nie, kan leerders net die digthede van die onderskeie materiale vergelyk deur die bekers in hulle hande te hou.
HIPOTESE:
Wat voorspel jy: Watter materiaal het die hoogste digtheid: sand, meel, water of lug?
IDENTIFISEER VERANDERLIKES:
Indien 'n vaste volume (dieselfde grootte beker) van elke materiaal gebruik word, is volume die konstante of vaste veranderlike. Die bekers moet almal van dieselfde materiaal gemaak wees sodat hulle dieselfde massas het.
Die onafhanklike veranderlike is die tipe materiaal.
Massa word gemeet en gebruik om digtheid te bereken.
MATERIALE EN APPARAAT:
- vier identiese bekers (papier of plastiek)
- sand
- meel
- kraanwater
- driebalkbalans of skaal
METODE:
Jy gaan hierdie ondersoek self ontwerp. As julle in groepe werk, moet julle eers bespreek hoe julle die ondersoek gaan uitvoer (doen). Dit is die beplanning. Skryf jou voorgestelde metode in jou notaboek of op rofwerkpapier neer. Bespreek dit met jou onderwyser. Onthou om ook te dink aan hoe jy jou resultate gaan noteer. Nadat jy die ondersoek voltooi het, moet jy jou metode in die lyne wat hier verskaf word, neerskryf. Som elke stap in vorgorde op en nommer die stappe.
Leerders moet die stappe vir hulle ondersoek in 'n genommerde volgorde skryf. As jy toegang het tot 'n skaal of driebalkbalans, kan hulle die massa van elke beker bepaal en dit gebruik om die digtheid te bereken. Hulle sal moet weet wat die volume van die bekers is om dit te kan doen. Die volume mag dalk op die bekers geskryf staan, maar indien nie, vra hulle hoe hulle die volume gaan bepaal. 'n Voorstel is om die beker met water te vul en hierdie water dan in 'n houer met mate (bv. 'n maatbeker of maatsilinder) te gooi en die volume te noteer.
RESULTATE EN WAARNEMINGS:
Wat was die resultate van jou ondersoek? Som hulle hieronder op. Jy kan 'n tabel teken. Indien jy die massa van elke beker kon meet, toon jou berekeninge van die digtheid van elke materiaal.
As leerders die massas van die bekers met die verskillende materiale kon bepaal, moet hulle die digthede bereken met behulp van die vergelyking\(D = m/V\).
'n Voorbeeld van so 'n berekening:
Massa van beker meel = \(\text{150}\) g
Volume van beker = \(\text{250}\) ml
\(D = m/V\)
= 150/250
= \(\text{0,6}\) g/ml
ANALISE EN EVALUERING:
Leerder-afhanklike antwoord.
Leerder-afhanklike antwoord.
Leerder-afhanklike antwoord. Hulle behoort iets in te sluit oor die gebruik van dieselfde beker vir elke meting.
GEVOLGTREKKING:
Wat is jou gevolgtrekking? (Wat is jou antwoord op die ondersoekende vraag?)
Hierdie ondersoek moet toon dat gelyke volumes van hierdie verskillende materiale verskillende massas het en dus verskillende digthede. Jy kan ook daarop wys dat hulle ook materiale in verskillende toestande vergelyk het, en dat hulle ook twee vaste stowwe, naamlik sand en meel, vergelyk het.
In die vorige ondersoek het ons gesien dat twee vaste stowwe, naamlik sand en meel, verskillende digthede het omdat hulle verskillende materiale is. Maar wat van vloeistowwe? Het alle vloeistowwe dieselfde digtheid of het die tipe materiaal 'n effek op die digtheid?
Het jy al ooit opgelet dat olie op water dryf?

Wanneer jy olie en water meng, soos in die foto van die slaaisous hieronder, sal die twee materiale mettertyd skei omdat hulle nie goed meng nie. Hulle is onmengbaar. Wanneer hulle skei, sal die olie altyd bo dryf. Daar word na die twee afsonderlike lae verwys as 'fases', die oliefase en die waterfase.
Skep jou eie vloeistofsimulasie van olie en water. http://www.escapemotions.com/experiments/fluid_water_3/
Bring kookolie klas toe en demonstreer dit deur 'n bietjie olie in 'n glas water te gooi. Roer dit om die olie en water te 'meng' en laat hulle dan weer in die verskillende lae uitskei. Die simulasieskakel wat hier gegee word is nogal pret vir leerders om mee te eksperimenteer en te kyk wat gebeur op partikelvlak wanneer olie, water en skuim gemeng word, en ook wanneer hulle weer uitskei.

Olie dryf op water vir twee redes:
- 'n Beker olie het minder massa as 'n beker water. Die olie is minder dig as die water. Dit veroorsaak dat olie op water dryf, net soos 'n kurkprop of luggevulde rubbereend op die oppervlak van water dryf.

-
Olie los nie in water op nie. Die oliemolekules tros saam en dryf op die oppervlak. As 'n groot hoeveelheid olie in water gegooi word, sal die olie uitsprei en 'n laag op die oppervlak van die water vorm. Olie wat in die see of 'n meer gestort word, versprei oor 'n groot area. Dit vergiftig baie diere, voëls, visse en plante en is baie duur om op te ruim. Dit is waarom oliebesoedeling 'n baie negatiewe impak op ons omgewing het.


Wanneer twee stowwe in dieselfde houer is, maar nie gemeng nie (soos olie en water byvoorbeeld), sal hulle twee lae vorm. In 'n sekere sin vorm water en ys ook twee 'lae'. Watter laag sal bo wees: die een wat digter is of die een wat minder dig is?
Die laag wat minder dig is sal bo-op die digter laag dryf.
In die volgende aktiwiteit kyk ons hoe ons verskillende vloeistowwe in lae opmekaar kan kry, afhangende van hul digthede!
Reënboog digtheidskolom
Hierdie aktiwiteit kan as 'n klasdemonstrasie vir die pret gedoen word. Dit gee 'n baie duidelike illustrasie van die verskille in digtheid van verskillende vloeistowwe. Jy hoef nie al die items in die gegewe lys van materiale te gebruik nie, solank jy 'n paar van verkillende digthede het. Kyk na die Steve Spangler Science video voordat jy hierdie demonstrasie in die klas doen, om 'n goeie idee te kry van hoe om dit korrek te demonstreer.
'n Video wat wys hoe om 'n reënboog digtheidskolom te maak.
MATERIALE:
- groot glasvaas of 'n liter maatsilinder
- plastiekbekers
- heuning
- goue stroop
- volroommelk
- skottelgoedwasmiddel
- water (kan met byvoorbeeld blou voedselkleursel gekleur word)
- plantolie
- chirurgiese alkohol (kan byvoorbeeld met rooi voedselkleursel gekleur word)
- 'n bout
- 'n springmieliepit
- 'n kersietamatie
- 'n paar plastiekkrale
- 'n tafeltennisbal/polistireenbal
INSTRUKSIES:
As jy gelyke volumes van elke vloeistof het, sal daar 'n verwanskap tussen die massa en digtheid wees en die swaarste vloeistowwe sal die digste wees. Teken 'n tabel op die bord om die massa van elke vloeistof te noteer.
As jy die voorgestelde vloeistowwe in die gegewe lys gebruik, is die volgorde waarin hulle ingeskink word: heuning, goue stroop, melk, skottelgoedwasmiddel, water, plantolie, chirurgiese alkohol.
- Gebruik dieselfde hoeveelheid van elke vloeistof. Die hoeveelheid sal bepaal word deur die hoogte van die vaas of die maatsilinder. Skink gelyke volumes van elke vloeistof in die bekers.
- As jy toegang het tot 'n skaal, meet die massa van elke beker met 'n ander vloeistof. Rangskik hulle in volgorde van swaarste tot ligste.
- Begin met die swaarste vloeistof (heuning) en gooi dit eerste in die houer. Sorg dat dit nie die kante van die houer raak nie.
- Skink vervolgens die volgende swaarste vloeistof in totdat jy al die vloeistowwe in die houer geskink het. As jy 'n pipet het, kan jy dit gebruik om die vloeistowwe versigtig in lae by te voeg.
- Plaas die kolom op 'n lessenaar en laat die bout, springmieliepit, kersietamatie en krale versigtig inval. Let op waar elke voorwerp in die digtheidskolom gaan lê.
- Laat die tafeltennisbal/polistireenbal heel laaste bo-op val.
VRAE:
Die heuning is die digste, want dit lê heel onder; die chirurgiese alkohol het die laagste digtheid, want dit dryf bo-op al die ander lae.
Ja, daar is 'n verwantskap. In gelyke volumes van die vloeistowwe is die vloeistof wat die swaarste is, die digste.
Let wel: Hiermee word die idee van die verklaring van wetenskaplike verskynsels deur vergelykings, ingevoer (digtheid = massa/volume). Indien die volume konstant bly en die massa toeneem, dan moet die digtheid ook toeneem. Leerders hoef nie op hierdie vlak berekeninge te doen nie, maar as jy die oefening wil uitbrei, kan julle die digtheid van elke vloeistof bereken deur die gemete massa en die volume vir elke vloeistof te gebruik.
Dit hang af van watter voorwerpe gebruik word. As die voorgestelde voorwerpe gebruik word, sal die volgorde wees: bout, springmieliepit, kersietamatie, krale, tafeltennisbal. Die digste voorwerpe sal onder lê en die minste dig sal bo wees.
Die voorwerpe val na die verskillende vlakke na gelang van hulle digthede. Die metaalbout is digter as enige van die vloeistowwe en dus sink dit tot heel onder. Elkeen van die ander voorwerpe sal sink tot by die vlak waar sy digtheid gelyk is aan dié van die vloeistof.
Let wel: Leerders mag dalk hiermee sukkel, maar jy kan vir hulle 'n voorbeeld gee. Die plastiekkrale is byvoorbeld minder dig as water en die vloeistowwe onder dit, maar hulle is digter as die plantolie en die vloeistowwe bokant dit. Dus sal die krale bo-op die waterlaag dryf.
Afhangende van watter voorwerpe gebruik is, maar van die voorgestelde lys, is dié wat minder dig is as water die tafeltennisbal en plastiekkrale, terwyl die kersietamatie, springmieliepitte en bout digter as water is.
'n Paar berekeninge van digtheid
Hierdie is 'n uitbreidingsaktiwiteit as jy 'n paar digtheidsberekeninge wil doen. Berekeninge sal 'n belangrike deel van fisiese wetenskappe in Gr. 10-12 word en dit is dus nuttig as leerders begin om nou reeds sommige van die eenvoudiger vergelykings te gebruik.
INSTRUKSIES:
- hieronder is 'n tabel met 'n paar stowwe en hul digthede. Gebruik hierdie inligting om die volgende berekeninge te doen.
- Toon hoe jy elke antwoord bereken het en onthou om die eenhede in jou antwoord in te sluit.
Materiaal | digtheid (g/ml) |
water (vloeistof) | 1 |
ys | 0.917 |
glas | 2.6 |
sout | 2.2 |
bordkryt | 2.36 |
steenkool | 1.5 |
kurk | 0.25 |
VRAE:
\(D = m/V\)
= 500/555
= 0.9 g/ml
Bordkryt is digter.
Digtheid van glas = 2.6 g/ml.
\(D = m/V\)
\(V = m/D\)
= 50/2.6
= 19.2 ml
Die steenkool se massa sal groter wees omdat dit 'n hoër digtheid het.
Massa van steenkool:
\(m = DV\)
= 1.5 x 100
= 150 g
Massa van kurk:
\(m = DV\)
= 0.25 x 100
= 25 g.
Ons het geleer dat die digtheid van 'n materiaal afhang van hoe styf die partikels in die materiaal gepak is. Hoe stywer hulle gepak is, hoe digter sê ons is hulle.
Die volgende diagram stel 'n houer (links) voor wat 'n klein hoeveelheid gas bevat. Stel jou voor dat al die gas van die klein houer verskuif word na die leë houer aan die regterkant. Teken die gaspartikels in die houer regs.
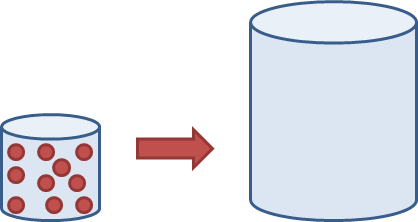
Die leerder se skets behoort 10 partikels te toon wat egalig uitgesprei is om die groter houer te vul. Let daarop dat die partikels dieselfde grootte as tevore moet hê.
'n Gas sal uitsit om enige ruimte waarin dit is, te vul. Ons sal steeds dieselfde aantal gaspartikels in die groter houer hê, maar hulle vul nou 'n veel groter ruimte.
As ons 'n sekere hoeveelheid gas van een houer neem en dit in 'n ander, groter houer plaas, sit die gas uit om die groter houer te vul. Dieselfde massa gas is nou in 'n groter volume, en die gas het nou 'n laer digtheid.
Vaste stowwe en vloeistowwe kan nie so optree nie. Hulle digthede sal min of meer dieselfde bly ongeag die houer waarin hulle geplaas word. Dit is omdat hul partikels relatief naby mekaar is met sterk kragte tussen hulle. Maar wat gebeur as ons hulle verhit? Ons het geleer dat dit dieselfde is as om hulle ekstra energie te gee. Hoe sal verhitting die pakking van die partikels en die digtheid beïnvloed?
Laat leerders hierdie vraag bespreek. Hulle het geleer dat partikels vinniger beweeg by hoër temperature. Hoe sou dit die spasies tussen die partikels beïnvloed? Die meeste vaste stowwe en vloeistowwe word minder dig namate hulle warmer word. Die leerders hoef nie in hierdie stadium tot enige gevolgtrekking te kom nie. Die vraag sal egter help om die konsepte van inkrimping en uitsetting in te lei.
In die volgende afdeling gaan ons van nader beskou wat met die partikels gebeur binne materiale wanneer hulle uitsit. Ons gaan ook kyk na die omgekeerde van uitsetting, naamlik inkrimping.
Uitsetting en inkrimping van materiale
- uitsit
- inkrimp
- versterk
Was jy al ooit in 'n sinkdakhuis? Op warm dae hoor mens dikwels hoe kreun en kraak die metaaldakpanele. Weet jy hoekom dit gebeur?

Sommige materiale word effens groter as hulle verhit word. Ons sê dat hulle uitsit. Materiale kan ook effens kleiner word wanneer hulle afgekoel word. Ons sê dat hulle inkrimp.
Die metaalpanele van die dak sit uit en krimp in namate die temperatuur buite verander. Wanneer dit gebeur, skraap die panele teen mekaar en teen die spykers wat hulle in posisie hou. Die skraap van metaal teen metaal veroorsaak die kraak- en kreungeluide.
Hoe is dit moontlik vir metale om te krimp en uit te sit? Kan jy aan 'n verduideliking dink?
Laat leerders bespiegel oor die moontlikheid dat nuwe atome wat in die materiaal vorm, die verskynsel van uitsetting kan verklaar. Lei hulle na die wet van behoud van materie: materie kan nie geskep of vernietig word nie. Materiale sit uit en krimp omdat partikels verder uitmekaar of nader aan mekaar beweeg, nie omdat die aantal partikels toeneem of afneem nie.
Om hierdie verskynsel te verstaan, sal ons na 'n paar voorbeelde van uitsetting kyk. Ons sal dan probeer om uitsetting aan die hand van die deeltjiemodel te verklaar.
Sommige vaste stowwe sit meer as ander uit. Wanneer ons materiale vir 'n nuwe projek kies, is dit belangrik om te weet hoeveel hulle sal uitsit. Sodoende sal ons weet hoeveel om toe te laat vir uitsetting wanneer die materiale warm word.
In die volgende diagram toon die beeld links 'n padoppervlak van beton. Hoe het die ingenieurs wat die pad gebou het, voorsiening gemaak vir uitsetting?
Die pad is in segmente gebou, met klein gapings tussen die segmente om toe te laat vir uitsetting.

Die beeld regs wys wat kan gebeur as geen voorsiening gemaak is vir die uitsetting van die betonblokke nie. Die kragte wat ontstaan as gevolg van die uitsetting van die beton is so sterk dat die oppervlak gekraak het!
Dit is 'n baie belangrike beginsel om te onthou by die bou van brûe. Wanneer ingenieurs 'n brug ontwerp, moet hulle voorsiening maak vir die inkrimping en uitsetting van die materiale waarvan die brug gebou word. Kyk na die volgende nabyfoto van die gaping tussen die twee padoppervlakke van 'n brug. Kan jy die inmekaarsluitende 'tande' sien? Hulle laat die brug toe om uit te sit en in te krimp terwyl die tande by mekaar verbygly.

Hoeveel langer?
In hierdie aktiwiteit gaan ons die uitsetting van verskillende vaste stowwe vergelyk deur 'n grafiek te trek. Jy sal die volgende inligting vir jou grafiek benodig:
Materiaal | Hoe ver 'n 100 meter lengte van die materiaal sal uitsit as die temperatuur met 10°C toeneem |
Geelkoper | 19 mm |
Yster | 12 mm |
Staal | 11 mm |
Platinum-allooi | 10 mm |
Beton | 11 mm |
Gewone glas | 11 mm |
Oondvaste glas | 3,5 mm |
Trek 'n staafgrafiek met 'Uitsetting' op die y-as en 'Materiale' as kategorieë op die x-as. Kies 'n gepaste titel vir jou grafiek.
Hier is die staafgrafiek wat leerders moet teken. Enige gepaste titel sal werk, byvoorbeeld: Uitsetting van verskillende materiale as temperatuur met 10°C (per 100 meter materiaal) verhoog word.
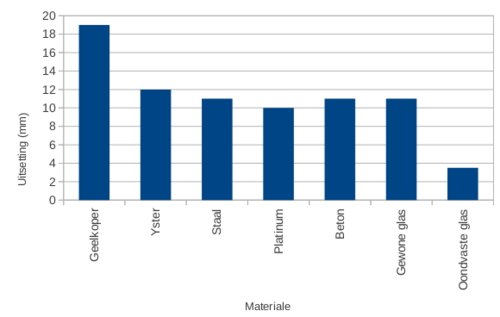
VRAE:
Geelkoper
Oondvaste glas
Watter vaste stof sal die beste materiaal wees om beton te versterk? (Wenk: die versterkingsmateriaal moet net soveel soos die beton uitsit, anders sal dit die beton tydens uitsetting beskadig.)
Staal. Dit sit net soveel soos beton uit.
Ons kan van die grafiek en die data in die tabel sien dat geelkoper baie meer as gewone glas uitsit. Wanneer die weer regtig baie warm word, sit die geelkoper soveel uit dat die glasruite nie meer behoorlik pas nie en uitval.
- Vervang die geelkoperrame met staal. Staal sit net soveel soos glas uit en die glas behoort in posisie te bly.
- Vervang die groot vensters met kleiner vensters. Kleiner items sit minder uit omdat daar minder materie is wat kan uitsit.
Let wel: Buiten die tipe materiaal, hang die mate van uitsetting ook af van hoeveel materie daar is. Dit is waarom uitsetting moeilik gesien kan word in relatief klein items, soos bv. kookpotte. 'n Sleutel sal steeds in 'n slot pas, selfs as die sleutel in die warm son gelê het, want uitsetting is nie so merkbaar in klein items nie.
Die volgende diagram toon 'n metaalbal- en ringapparaat. Die ring en bal is albei van geelkoper gemaak. By kamertemperatuur is die bal net groot genoeg om deur die ring te gaan.
Dink jy die bal sal steeds deur die ring pas wanneer die bal verhit is?
Die bal pas nie deur die ring wanneer die bal verhit is nie.
Let wel: Hierdie is 'n goeie manier om uitsetting en inkrimping te demonstreer as jy een van hierdie apparate by jou skool het.
As jy 'n praktiese demonstrasie doen, laat die leerders eers 'n voorspelling maak voordat jy voortgaan met die demonstrasie. Jy kan die bal in die vlam van 'n Bunsenbrander warm maak.
Nee, die geelkoperbal kan nie 'n groter massa hê nie, want dit het nie enige massa bygekry nie.
Let wel: Ons weet dit want materie kan nie geskep (of vernietig) word nie.
Die bal sal na dieselfde grootte as tevore inkrimp omdat dit nie enige massa bygekry of verloor het nie.
Let wel: Indien jy die praktiese demonstrasie doen, laat die leerders 'n voorspelling maak in die tyd wat dit neem vir die bal om af te koel.
Noudat ons gesien het dat materiale kan uitsit, hoe kan ons die uitsetting van 'n materiaal verklaar aan die hand van die gedrag van die partikels in daardie materiaal?
Laat leerders dit vir 'n paar minute bespreek. Lei die bespreking met die volgende vrae: Wat voeg ons tot materiale by wanneer ons hulle verhit? (Energie.) Wat doen partikels wanneer hulle meer energie ontvang? (Hulle beweeg vinniger.) Wat gebeur met die spasies tussen die partikels namate hulle vinniger beweeg en met meer krag teen mekaar bots? (Die spasies word groter namate die partikels verder uitmekaar beweeg.) Leerders moet aangemoedig word om aantekeninge te neem tydens besprekings.
Ons het geleer dat wanneer materie verhit word, die partikels van daardie materie vinniger sal beweeg en verder van mekaar sal wegbeweeg. Wat gebeur met die partikels in materie wanneer dit afgekoel word?
Laat die leerders dit vir 'n paar minute bespreek. Lei die bespreking met die volgende vrae: Wat verwyder ons van materie wanneer ons dit afkoel? (Energie.) Wat gebeur met partikels wanneer hulle energie verloor? (Hulle beweeg stadiger.) Wat gebeur met die spasies tussen die partikels wanneer hulle stadiger beweeg? (Die spasies word kleiner namate die partikels nader aan mekaar begin beweeg.)
Wanneer 'n stof afkoel (energie word verwyder), sal die partikels in daardie stof stadiger begin beweeg en nader aan mekaar beweeg. Dit is waarom die meeste materiale krimp wanneer hulle afgekoel word.
Uitsetting en inkrimping in 'n termometer
Kom ons beskou 'n termometer om uitsetting en inkrimping te verstaan.
Hoe werk 'n termometer?
In Gr. 7 Materie en Materiale is leerders bekendgestel aan die boltermometer en die idee dat materiale uitsit en inkrimp as gevolg van veranderinge in kinetiese energie van die partikels (die grootte en getal partikels bly dieselfde, en slegs die spasies tussen die partikels neem toe of af). Indien jy toegang het tot 'n Gr. 7 werkboek, kan jy kyk na dit wat hulle gedoen het. Jy kan ook die PDF-lêers van hierdie boeke van die webtuiste aflaai en die inhoud aanlyn besigtig. Hierdie idees word in hierdie aktiwiteit herbesoek en uitgebrei, met die deeltjiemodel as raamwerk. Belangrike verwantskappe tussen uitsetting en inkrimping, en hul effek op die eienskappe volume en digtheid, word vasgelê.
Die bekende glastermometer word 'n boltermometer genoem. Alle boltermometers het 'n taamlike groot bol wat verbind is aan 'n lang, dun buis. Daar is 'n helderkleurige vloeistof binne-in die termometer. Sommige termometers bevat kwik omdat dit heelwat uitsit en inkrimp wanneer dit verhit of afgekoel word.
Kwik is die enigste metaal wat 'n vloeistof by kamertemperatuur is.
Kyk mooi na die volgende stel diagramme. Hulle stel dieselfde termometer by twee verskillende temperature voor.

VRAE:
20°C
Die temperatuurlesing op die termometer regs is 10°C.
Sirkel A is die korrekte een. Die laer temperatuur het veroorsaak dat die vloeistof in die termometer inkrimp en die partikels dus nader aan mekaar is.
Let wel: Hierdie vraag bied 'n geleentheid om wanbegrippe by leerders in verband met uitsetting en inkrimping te identifiseer:
- Antwoord B is foutief omdat die partikels verder uitmekaar is as in die diagram aan die linkerkant. Die leerder verwar moontlik die twee konsepte uitsetting en inkrimping.
- Antwoord C is verkeerd omdat dit lyk asof die partikels in die diagram groter geword het. Dit is nie moontlik nie, aangesien partikels nie massa kan bykry nie (materie kan nie geskep of vernietig word nie), en ook nie volume kan bykry nie. Hulle massa en volume is vas, en uitsetting beteken hulle beweeg verder uitmekaar; die spasies tussen hulle word groter.
- Antwoord D is verkeerd omdat die partikels in die diagram lyk asof hulle kleiner geword het. Dit is 'n wanopvatting, vir dieselfde redes as wat so pas genoem is. Die spasies tussen partikels word kleiner wanneer 'n materiaal krimp.
Nee, die materiaal kan nie minder massa hê nie omdat dit steeds dieselfde aantal atome as tevore het en hulle massa konstant is.
Let wel: Hierdie is 'n goeie tydstip om leerders daaraan te herinner dat materie nie geskep of vernietig kan word nie.
Antwoord B sou nou die termometer by 'n hoër temperatuur van 30°C voorstel, omdat die partikels meer energie verkry het en dus vinniger beweeg en dus verder uitmekaar beweeg en die vloeistof dus uitsit.
Die volume van die materiaal neem toe, want die partikels beweeg verder uitmekaar. Die materiaal sit uit.
Die massa verander nie, maar die volume neem toe, en dus moet die digtheid afneem.
Let wel: Dit mag help om terug te verwys na die formule: digdheid = massa/volume.
Wanneer 'n materiaal verhit word, beweeg sy deeltjies verder uitmekaar. Verhitting en afkoeling veroorsaak dat die volume van die materiaal verander.
Ons het geleer dat om aan materie in terme van die deeltjies daarin te dink ons kan help om baie interessante verskynsels te verstaan: die fisiese eienskappe van die verskillende toestande van materie, veranderinge van een toestand van materie na 'n ander, digdheid, en uitsetting en inkrimping.
Hoe kan ons meet hoeveel van 'n vloeistof of vaste stof ons het? As ons wil weet hoeveel van 'n materiaal ons het, kan ons sy massa meet. Watter instrument gebruik ons om massa te meet?
'n Skaal of 'n balans.
Dink terug aan die ondersoek waarin die digdhede van sand, water, meel en lug vergelyk is. Hoe het jy die massa van die lug in die koppie gemeet?
Mees waarskynlik sal die leerders nie daartoe instaat wees om die massa van lug te meet nie. As hulle dit wel reggekry het, sou dit waarskynlik 'n redelik ingewikkelde proses benodig het. Hulle behoort herinner te word dat die lug nie massaloos is nie, maar dat die massa van die lug in die koppie baie, baie min is. (Dit is eintlik nie moontlik om die massa van die lug te meet as dit omring is deur meer lug nie. Een manier om die gewig van lug te meet sou wees om dit in 'n vakuum te doen, maar dit is buite die omvang van hierdie bespreking vir die leerders). Die doel van hierdie kort bespreking is om die leerders vir die afdeling oor druk voor te berei. Die meet van die druk van 'n gas is een manier om te 'meet' hoeveel gas ons het.
Ons gaan nou ons fokus na gasse verskuif. Gasse het baie laer digthede as vaste stowwe of vloeistowwe. Dit beteken dat 'n groot volume gas 'n klein massa sal hê. Klein massa's kan moeilik wees om te meet sonder 'n spesiale, super-sensitiewe skaal. Wetenskaplikes het 'n ander manier uitgewerk om te meet hoeveel van 'n gas hulle het.
Druk
- drukmeter
- lugklep
Wat is gasdruk?
Ons het geleer dat gasse miljoene vinnig-bewegende deeltjies bevat. Die volgende prent verteenwoordig gasdeeltjies binne-in 'n houer.
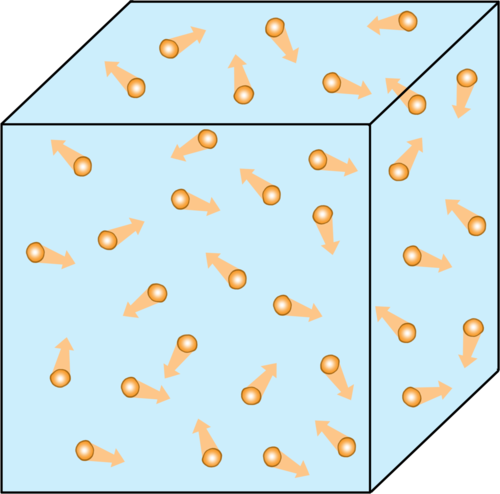
Soos die deeltjies teen 'n hoë spoed rondbeweeg, bons hulle van mekaar af. Hulle bots ook teen die binnekant van die houer. Die krag van die deeltjies wat teen die kante van die houer bots, veroorsaak gasdruk. Die getal botsings sal afhang van die aantal gasdeeltjies in die houer. Meer deeltjies binne die houer beteken meer botsings, en meer botsings veroorsaak 'n hoër druk.
As ons die druk van die gas kan meet, sal ons 'n idee hê van hoeveel gas daar in die houer is.
Wind is eenvoudig bewegende lug! Die beweging van die lug word veroorsaak deur verskille in druk tussen twee gedeeltes van die Aarde se atmosfeer. Wanneer die wind waai, is dit die atmosfeer wat die ongelyke drukke gelyk maak deur lug te laat beweeg vanaf die hoëdruk gebied na die lae druk gebied.
Hoe kan gasdruk gemeet word?
Het jy al ooit gesien hoe iemand die druk in 'n motorband meet? Jy mag gesien het hoe hulle 'n toestel gebruik soos die een in die foto hieronder. Dit word 'n banddrukmeter genoem, en dit is spesiaal ontwerp om die lugdruk binne-in 'n band te meet.

Die ronde kant van die meter moet teen die lugklep van die band gedruk word. Dit open die klep en laat van die lug in die band in die meter in ontsnap. Die lugdeeltjies bots teen 'n ronde plaatjie in die meter. Die krag wat uitgeoefen word deur baie gasmolekuul botsings stoot 'n staaf aan die agterkant van die meter uit. Kan jy dit in die prentjie sien? Vir hierdie spesifieke drukmeter word die druk in die band aangedui deur hoe ver die staaf aan die agterkant van die drukmeter uitgestoot word. Neem kennis van die getalle op die staaf wat ons toelaat om die druk te meet.
Hoe om banddruk te meet: http://www.howstuffworks.com/pressure-gauge.htm
Ander, meer ingewikkelde drukmeters werk almal op 'n soortgelyke wyse.


Hoe kan ons die hoeveelheid gas in 'n houer vermeerder? In die volgende aktiwiteit gaan ons sien of ons gasdruk kan verstaan in terme van die deeltjiemodel van materie.

Die verstaan van gasdruk
Een van die leerders kan hul fiets en fietspomp na die klas toe bring om die finale aktiwiteit te demonstreer.
MATERIALE:
- Bruinpapiersakke (medium grootte)
- ballonne
- leë plastiek koeldrank- of waterbottels (2-liter bottels is verkieslik)
- fietspomp en band
INSTRUKSIES:
- Blaas die bruinpapiersak ten volle op.
- Probeer om dit selfs nog meer op te blaas. Kyk of jy die sak kan bars deur in dit in te blaas.
- Skryf een of twee sinne om te beskryf hoe dit voel om om in 'n sak in te blaas wanneer die 'leeg' is, in vergelyking met wanneer dit 'vol' lug is. Voel dit verskillend? Is dit moeiliker om in die sak in te blaas wanneer dit alreeds vol is?
Dit is makliker om in die sak in te blaas wanneer dit 'leeg' is, of wanneer daar nie so baie lug in dit is nie. Dit word al hoe moeiliker om op te blaas soos dit meer vol lug word.
Let wel: As die sak sterk genoeg is mag dit dalk nie moontlik wees om dit te bars deur aan te hou om daarin te blaas nie, omdat mense nie met veel krag kan blaas nie. 'n 'Swak' sak mag langs sy some uitmekaarskeur, of begin lek wanneer leerders aanhou om lug daarin the forseer. Vra hulle om na te dink waarom dit gebeur.
-
'n Ballon is nodig vir hierdie stap.
Blaas 'n ballon op totdat dit so groot soos 'n lemoen is. Knyp dit toe, maar moet dit nie toeknoop nie.Blaas die ballon nou so groot op as wat jy kan.Probeer om dit selfs nog meer op te blaas. Kyk of jy die sak kan bars deur in dit in te blaas.Skryf twee of drie sinne om te beskryf hoe dit voel om in die ballon in te blaas wanneer dit 'leeg' is, in vergelyking met wanneer dit 'vol' lug is. Voel dit verskillend? Is dit moeiliker om in die ballon in te blaas wanneer dit alreeds vol lug is?Dit is aanvanklik moeilik om in die ballon in te blaas. Daarna word dit makliker om lug in die ballon in te blaas. Wanneer die ballon tot sy 'maksimum' vol lug gerek is, raak dit al moeiliker om meer lug daarin te blaas.
Let wel: Die ballon is aanvanklik moeilik om in te blaas omdat die materiaal (rubber) waarvan die ballon gemaak is dan nog baie styf is. Dit kan effens onstpan word deur die ballon te rek voordat daarin geblaas word, maar die eerste een of twee 'blase' sal redelike inspanning verg.
Knoop die opgeblaasde ballon toe. Laat die ballon in die klaskamer en ondersoek dit weer na 'n week. Lyk dit dieselfde as toe jy dit 'n week gelede opgeblaas het? Miskien lyk dit 'n bietjie soos die ballon in die volgende foto:

'n Afgeblaasde verjaardagballon. http://www.flickr.com/photos/robbophotos/2095823996/ Onthou om jou waarnemings hieronder neer te skryf.Let wel: Na een week het die ballon 'gekreukel' geraak, en is dit kleiner as wat dit oorspronklik was.
-
'n Ballon en 'n leë plastiekbottel word vir hierdie stap benodig.
Rek die ballon oor die bokant van die bottel, terwyl die ballon in die bottel in hang.Blaas in die ballon in. Wat neem jy waar? Kan jy die ballon opblaas?Dit is onmoontlik om die ballon op te blaas.
Maak nou 'n klein gaatjie in die bodem van die bottel. Blaas weer in die ballon in. Wat neem jy nou waar?Die ballon swel op en vul die binnekant van die bottel.
-
'n Fietsband en 'n fietspomp word vir hierdie stap benodig.
Gebruik die pomp om lug in die band in te pomp. Hou aan om te pomp totdat dit te moeilik raak om aan te hou om lug in die band in te pomp.Skryf 1 of 2 sinne oor jou waarnemings.Aanvanklik is dit maklik om lug in die band in te pomp, maar hoe meer jy pomp, hoe moeiliker raak dit.
VRAE:
Probeer om die volgende vrae te beantwoord deur te verduidelik wat met die lugdeeltjies in elke geval gebeur. Gebruik die woorde 'deeltjies', 'botsings' en 'druk' in jou antwoorde.
Lugdeeltjies word in die sak, ballon of band ingeforseer. Hoe meer jy blaas, hoe meer deeltjies word in die sak, ballon of band ingeblaas. As daar meer deeltjies is, sal daar meer botsings wees, wat beteken dat die druk groter sal wees.
Wanneer die sak so baie deeltjies bevat as wat dit moontlik kan en ons probeer om nog meer deeltjies in die sak in te forseer, raak die krag van die botsings teen die binnekant van die sak te groot en breek dit.
Wanneer die ballon soveel deeltjies bevat as wat dit moontlik kan, sal dit tot maksimum grootte gerek wees. As ons probeer om nog meer deeltjies in die ballon in te forseer, raak die krag van die botsings van die deeltjies teen die binnekant van die sak te veel en bars die ballon.
Let wel: Eintlik skeur die polimeerdraadjies van die ballon uitmekaar as gevolg van die toegepaste krag.
Waarom dink jy het die ballon kleiner geraak het nadat dit vir 'n week gelaat is? Die volgende diagramme behoort 'n leidraad te gee:
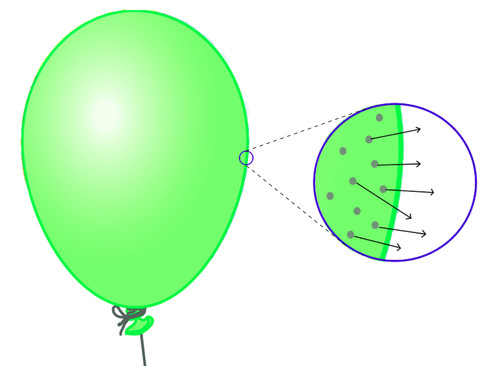
Lugdeeltjies ontsnap deur klein openinge in die ballonmateriaal. Daar is nou minder deeltjies binne-in die ballon, en dus is daar minder botsings teen die binnekant. Die krag wat teen die binnekant van die ballon druk is nou kleiner, en gevolglik is die druk in die ballon minder.
Let wel: Leerders mag antwoord dat die lug in die ballon ingekrimp het, en alhoewel dit deel van die verduideliking mag wees, is daar nog 'n faktor wat baie meer beduidend oor tyd tot die krimping bydra: lugdeeltjies sal stadig oor 'n periode van tyd vanuit die ballon ontsnap omdat die ballonpolimeer klein gaatjies het. Hierdie gaatjies is veels te klein om met die blote oog te sien, maar hulle is groot genoeg vir die lugmolekule om deur te onstnap.
Die ballon blaas nie veel op nie omdat die bottel alreeds met lug gevul is. Daar is geen ruimte vir die ballon om binne-in die bottel uit te sit nie. Die lugdeeltjies binne-in die bottel druk terug teen die deeltjies binne-in die ballon. Wanneer die bottel 'n gaatjie in het, kan die lugdeeltjies in die bottel daardeur uitgedruk word soos die die ballon die ruimte binne-in die bottel vul.
Hoe meer jy pomp, hoe meer deeltjies word in die band ingedruk. As daar meer deeltjies is, is daar meer botsings, en dus ook 'n groter druk. Die band sal rek om meer lugdeeltjies te akkommodeer, maar dit sal al moeiliker raak (wat meer en meer krag sal verg) om die bandmateriaal te rek.
Die volgende twee paragrawe word nie deur KABV vereis nie, maar mag ingesluit word as verryking. Dit stel sekere konsepte wat in latere grade behandel sal word, bekend.
Hoe verander verhitting of afkoeling 'n gas se druk?
As die gas verhit word, sal die deeltjies vinniger beweeg soos hulle meer energie verkry. Dit beteken dat hulle meer gereeld met die binnekant van die houer sal bots, en met meer krag. Dit veroorsaak 'n toename in druk.
As die gas afgekoel word, sal die deeltjies stadiger beweeg omdat hulle minder energie sal hê. Die gasdruk sal afneem, omdat die deeltjies minder gereeld en met minder krag teen die binnekant van die houer sal bots. Kyk na die volgende tabel wat dit illustreer.
Koel gas | Warm gas |
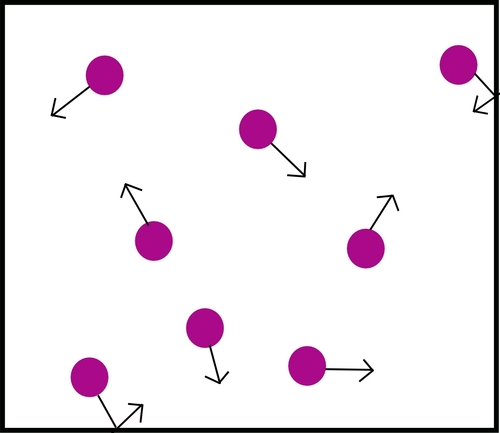 |  |
Minder en minder energieke botsings. | Meer en meer energieke botsings. |
Hoe verander die verandering in die volume van 'n gas sy druk?
Wanneer 'n gas in 'n kleiner volume ingedruk word, het die deeltjies minder spasie om in te beweeg. Dit word in die diagram hieronder gewys. Het jy al opgelet dat wanneer mense in klein ruimtes ingedruk word, hulle meer gereeld teen dinge stamp? Op dieselfde wyse sal die gasdeeltjies meer gereeld met mekaar en met die binnekant van die houer bots as hulle minder spasie het om in te beweeg. Meer botsings beteken 'n hoër druk!
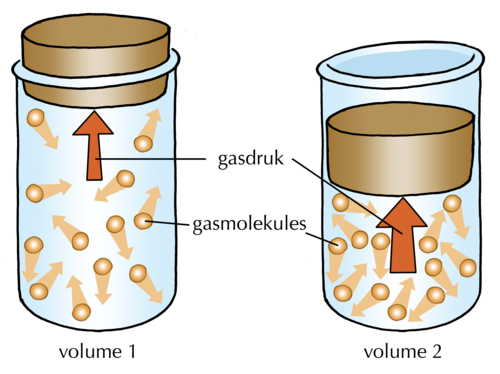
Ons het geleer dat 'n gas uit sal sit om al die beskikbare spasie te vul. Dus, wat sal gebeur as ons 'n sekere hoeveelheid gas uit een houer verwyder en dit in 'n ander houer wat twee maal so groot is plaas?
Die gas sal uitsit, en die groter houer vul.
Ons het nog steeds dieselfde aantal gasdeeltjies, maar nou is hulle in 'n baie groter volume. Daar is twee maal soveel spasie tussen die molekule as wat daar in die kleiner houer was.
Wat het met die digtheid van die gas gebeur? Het dit toegeneem, afgeneem, of dieselfde gebly?
Die digtheid het afgeneem omdat die volume togeneem het.
In hierdie hoofstuk het ons geleer hoeveel verskillende fisiese eienskappe van materie beter verstaan kan word wanneer ons in terme van die gedrag van die deeltjies in die materie dink.
Opsomming
- Alle materie kan beskryf word in terme van die deeltjies waaruit dit bestaan, en hoe hulle gerangskik is. Hierdie verskriklike klein deeltjies word, afhangende van die tipe materiaal, atome of molekule genoem.
- Die teorie wat materie in terme van deeltjies beskryf, word die deeltjieteorie van materie genoem. Dit help ons om die mikroskopiese eienskappe van materie te verstaan in terme van die gedrag van die deeltjies in daardie materiaal.
-
Die deeltjiemodel beskryf die deeltjies in vaste stowwe as volg:
- Hulle is dig en reëlmatig gepak, en in vaste posisies;
- Die enigste beweging wat hulle toegelaat word is vibrasie;
- Hulle word bymekaargehou deur sterk kragte; en
- Die spasies tussen hulle is baie klein.
-
Die deeltjiemodel beskryf die deeltjies in vloeistowwe as volg:
- Hulle is naby aan mekaar, maar nie in vaste posisies nie;
- Hulle is in aanhoudende beweging, en gly by mekaar verby;
- Hulle word deur matig sterk kragte bymekaar gehou; en
- Die spasies tussen hulle is baie klein (in meeste gevalle slegs effens groter as die spasies tussen vaste deeltjies).
-
Die deeltjiemodel beskryf die deeltjies in gasse as volg:
- Hulle is in aanhoudende vinnige beweging;
- Hulle is nie op enige spesifieke manier gerangskik nie, maar is vry om te beweeg;
- Die kragte tussen hulle is swak; en
- Hulle is ver uitmekaar met groot, leë spasies tussen hulle.
- Aangesien vloeistof- en gasdeeltjies in aanhoudende beweging is, is hulle daartoe in staat om te diffundeer. Diffusie is 'n proses waarin deeltjies uitsprei deur 'n lukrake beweging vanaf 'n hoë na 'n lae konsentrasie, totdat hulle eweredig versprei is.
- Wanneer twee stowwe meng, vermeng hulle deeltjies totdat hul samestelling heeltemal uniform is. Hierdie proses word ook diffusie genoem, en is baie vinniger in gasse as in vloeistowwe, omdat die deeltjies in gasse verder uitmekaar is.
-
Toestandsveranderinge is gewoonlik die gevolg van verhitting of afkoeling:
- Wanneer 'n vaste stof verhit word sal dit na 'n vloeistof verander (in 'n proses wat smelting genoem word) en, wanneer dit verder verhit word, sal die vloeistof na 'n gas verander (in 'n proses wat verdamping genoem word).
- Wanneer 'n gas afgekoel word sal dit na 'n vloeistof verander (in 'n proses wat kondensasie genoem word) en, wanneer dit nog verder afgekoel word, sal die vloeistof na 'n vaste stof verander (in 'n proses wat vriesing genoem word).
- Die digtheid van 'n materiaal is 'n maatstaf van sy 'relatiewe swaarheid'. Digter materiale het 'n groter massa in verhouding tot hulle grootte; dit is waarom hulle 'swaar' voel.
-
Die digtheid van 'n materiaal hang van twee dinge af:
- die massa van die individuele deeltjies van daardie materiale - hoe groter die massa, hoe digter is die materiaal; en
- die grootte van die spasies tussen die deeltjies in die materiaal - hoe groter die spasies, hoe minder dig is die materiaal.
- Dit verduidelik hoe ons digtheid bereken, naamlik digtheid = massa/volume
- Materiale met 'n los tekstuur (soos byvoorbeeld brood en spons), het leë spasies of gate in hulle, wat beteken dat hulle minder massa relatief tot hulle volume het. Hierdie materiale is geneig om minder dig te wees.
- Materiale wat minder dig is dryf altyd op materiale wat digter is.
- Die materiedeeltjies beweeg aanhoudend. In vaste stowwe is hierdie beweging beperk tot vibrasies, maar in vloeistowwe en gasse het die deeltjies meer vryheid om rond te beweeg.
- Meeste materiale sal uitsit wanneer hulle verhit word, en inkrimp wanneer hulle afgekoel word. Dit is omdat verhitting die deeltjies verder uitmekaar laat beweeg, en afkoeling hulle nader aan mekaar laat kom.
- Wanneer ons wil weet hoe baie van 'n gas ons het, kan ons sy druk meet.
- Die 'druk' van 'n gas word veroorsaak deur die gasdeeltjies wat met die binnekant van die houer en met mekaar bots.
- Meer gasdeeltjies in die houer sal meer botsings teen die kante van die houer beteken, en dus groter druk.
Konsepkaart
Kyk na die konsepkaart wat wys hoe die baie konsepte wat betrekking het op die deeltjiemodel by mekaar inpas. Daar is 4 leë blokkies wat jy moet invul.
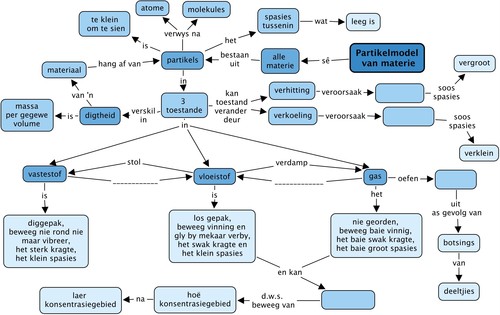
Onderwyser se weergawe
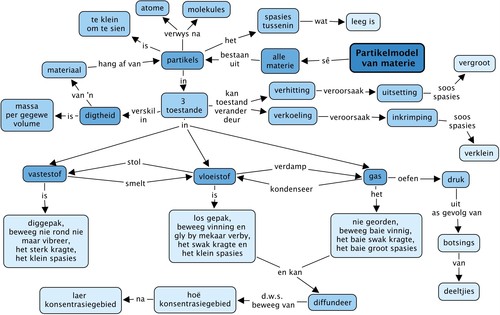
Hersieningsvrae
Gebruik hierdie vraag om te sien hoe leerders hierdie model verstaan. Hulle behoort iets soos die volgende te noem: Die deeltjiemodel van materie is 'n wetenskaplike model wat gebruik word om te beskryf hoe alle materie (vaste stowwe, vloeistowwe en gasse)uit deeltjies bestaan en hoe hulle in verskillende toestande optree. Leerders kan ook iets noem omtrent die grootte van die deeltjies, en dat daar leë spasies tussen die deeltjies is.
Water is ongewoon omdat sy vaste toestand minder dig as sy vloeistof toestand is, en gevolglik dryf ys op water. Dit is omdat daar groot spasies tussen die deeltjies in die vaste toestand is, wat die ys minder dig maak.
Voltooi die volgende tabel met die terme en definisies van die verskillende toestandsveranderings. [4 punte]
Toestandsverandering | Verduideliking |
Wanneer hitte toegevoeg word en 'n vaste stof na 'n vloeistof verander | |
Kondensering | |
Wanneer hitte toegevoeg word en die deeltjies by die oppervlak van 'n vloeistof na die gastoestand verander | |
Solidifisering |
Toestandsverandering | Verduideliking |
Smelting | Wanneer hitte toegevoeg word en 'n vaste stof na 'n vloeistof verander |
Kondensering | Wanneer hitte verwyder word en die gas na 'n vloeistof verander |
Verdamping | Wanneer hitte toegevoeg word en die deeltjies by die oppervlak van 'n vloeistof na die gastoestand verander |
Solidifisering | Wanneer hitte verwyder word en die vloeistof na 'n vaste stof verander |
Wanneer hitte toegevoeg word, begin die deeltjies vinniger en vinniger vibreer (soos hulle meer kinetiese energie verkry), totdat hulle vinnig genoeg beweeg om die kragte wat hulle in vaste posisies in die vaste stof hou, te oorkom. Die deeltjies is dan daartoe in staat om te beweeg en by mekaar verby te gly, aangesien hulle nie meer in 'n ordelike rangskikking in die vaste stof vasgehou word nie, en dus word die vaste stof 'n vloeistof.
Voltooi die volgende sin deur dit weer volledig uit te skryf: Gedurende uitsetting word die spasies tussen die partikels _____, en gedurende inkrimping (kontraksie), word die spasies tussen die deeltjies _____. [2 punte]
Gedurende uitsetting word die spasies tussen die deeltjies groter, en gedurende inkrimping word die spasies tussen die deeltjies kleiner.
Wanneer 'n metaal uitsit (omdat dit verhit word) beweeg die deeltjies verder uitmekaar. Die stuk metaal sal groter word, maar dit sal nog steeds dieselfde aantal deeltjies hê, en gevolglik ook nog steeds dieselfde massa. Die digtheid van die metaal het afgeneem.
Olie is minder dig as water, en daarom dryf dit op water.
Leerder se prent behoort lukrake beweging van die parfuumdeeltjie te wys, met baie rigtingveranderings.
Die petroldampe rondom die vulstasie is in die gas (of damp) fase. Die gasdeeltjies kan vryelik rondbewweg en diffundeer in die lug rondom die pompe in. As jy 'n vuurhoutjie naby die pompe aansteek, kan die petrolgas ontvlam, en dit kan 'n vuur of ontploffing veroorsaak.
Let wel:Gewoonlik is die ondergrondse brandstoftenks beskerm teen ontploffings of vure. Sommige mense sê dat klein vonke (veroorsaak deur statiese ladings) vanaf selfone ook die ontbranding van petroldampe kan veroorsaak, maar wetenskaplikes stem oor die algemeen nie hiermee saam nie.
Lug is 'n gas en water is 'n vloeistof. Gasdeeltjies bevat groter spasies en dit beteken dat hulle maklik is om saam te pers of saam te druk. Die spasies tussen vloeistofdeeltjies is so klein dat vloeistowwe nie saamgepers kan word nie. Dit is waarom die suier beweeg wanneer daar lug in die fietspomp is, maar nie veel beweeg as die pomp water bevat nie.
Die volgende tabel verteenwoordig 'n opsomming van die hele hoofstuk. Jy moet dit in jou eie woorde en met jou eie diagramme voltooi. Sommige van die blokkies in die tabel bevat alreeds inligting om jou te help om jou eie sinne te voltooi. [18 punte]
Toestande van materie | Vaste stof | Vloeistof | Gas |
|
Diagram wat wys hoe die deeltjies gerangskik is |  | ||
Rangskikking van die deeltjies | Baie naby (dig) gepak. Reëlmatige rangskikking | ||
Spasies tussen partikels | Baie groot | ||
Aantrekkingskragte tussen deeltjies | Sterk, maar swakker as in vaste stowwe | ||
Beweging van partikels | Vinnige en lukrake beweging | ||
Vorm | Geen vaste vorm Hang af van die houer | ||
Volume | Geen vaste volume nie Hang af van die houer | ||
Saampersbaarheid | Kan nie saamgepers word nie. | ||
Diffusie | Diffundeer stadig | ||
Digtheid in vergelyking met die ander toestande | Hoogste digtheid (behalwe in die geval van ys) | Amper so dig soos die vaste stof |
Toestande van materie | Vaste stof | Vloeistof | Gas |
|
Diagram wat wys hoe die deeltjies gerangskik is |  |  |  |
Rangskikking van die deeltjies | Baie naby (dig) gepak. Reëlmatige rangskikking | Naby mekaar, maar ongeorden. | Ver van mekaar en ongeorden. |
Spasies tussen partikels | Baie klein spasies. | Klein spasies. | Baie groot |
Aantrekkingskragte tussen deeltjies | Sterk | Sterk, maar swakker as in vaste stowwe | Baie swak |
Beweging van partikels | Vibrasie alleenlik | Glybeweging, lukraak. | Vinnige en lukrake beweging |
Vorm | Vaste vorm | Geen vaste vorm Hang af van die houer | Geen vaste vorm |
Volume | Vaste volume | Vaste volume | Geen vaste volume nie Hang af van die houer |
Saampersbaarheid | Kan nie saamgepers word nie. | Effense saampersing is somtyds moontlik | Baie saampersbaar |
Diffusie | Diffundeer nie | Diffundeer stadig | Diffundeer vinnig |
Digtheid in vergelyking met die ander toestande | Hoogste digtheid (behalwe in die geval van ys) | Amper so dig soos die vaste stof | Lae digtheid |
Totaal [42 punte]



